Урок по изучению нового материала. Сравнение ковалентной полярной и ковалентной неполярной связей.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Урок по химии в 8 классе "Ковалентная полярная связь"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Урок по химии в 8 классе "Ковалентная полярная связь"»
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
2200 руб.
3140 руб.
2200 руб.
3140 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства
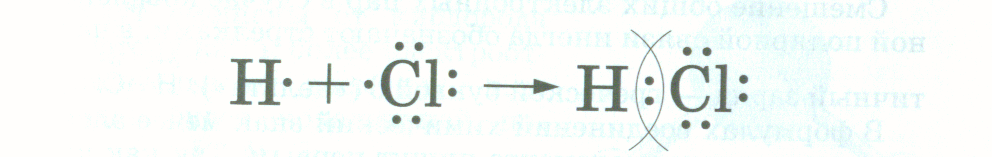

 Сколько атомов фтора может соединиться с атомом кислорода и почему? Ответ: Два, потому что у атома фтора не хватает до завершения энергетического уровня один электрон, а у кислорода – два. Учитель: как мы это отразим в записи: Ответ: (Запись на доске)
Сколько атомов фтора может соединиться с атомом кислорода и почему? Ответ: Два, потому что у атома фтора не хватает до завершения энергетического уровня один электрон, а у кислорода – два. Учитель: как мы это отразим в записи: Ответ: (Запись на доске) 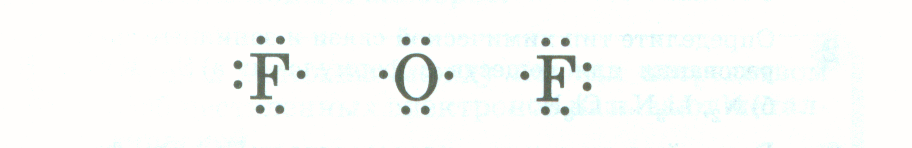 Учитель: Запишем схему образования вещества:
Учитель: Запишем схему образования вещества: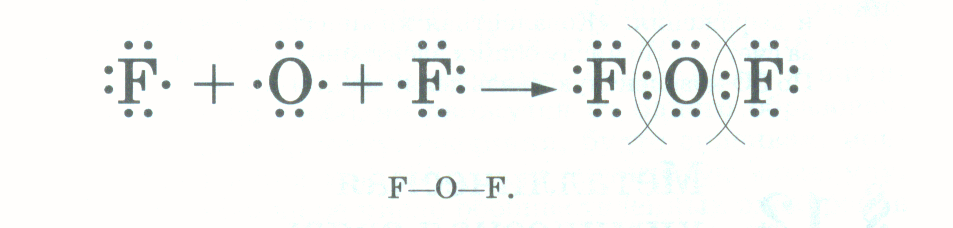 Учитель: К какому элементу смещены общие электронные пары? Ответ: К атому фтора как самому электроотрицательному элементу. Структурная формула будет такой Fδ-← Oδ+ → Fδ- . Учитель: Запишем еще схему образования молекулы воды:
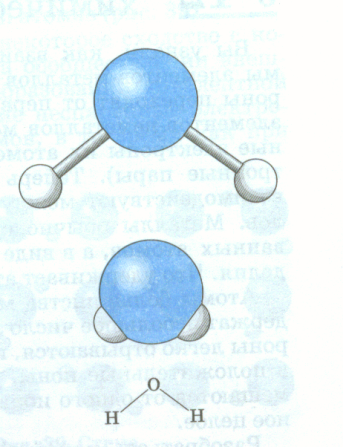
Учитель: К какому элементу смещены общие электронные пары? Ответ: К атому фтора как самому электроотрицательному элементу. Структурная формула будет такой Fδ-← Oδ+ → Fδ- . Учитель: Запишем еще схему образования молекулы воды: 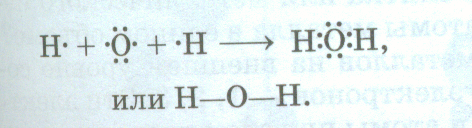 На самом деле молекула воды имеет не линейную форму, а угловую форму, угол между направлениями связей равен 1040271. Поэтому строение молекулы воды можно изобразить так:
На самом деле молекула воды имеет не линейную форму, а угловую форму, угол между направлениями связей равен 1040271. Поэтому строение молекулы воды можно изобразить так: