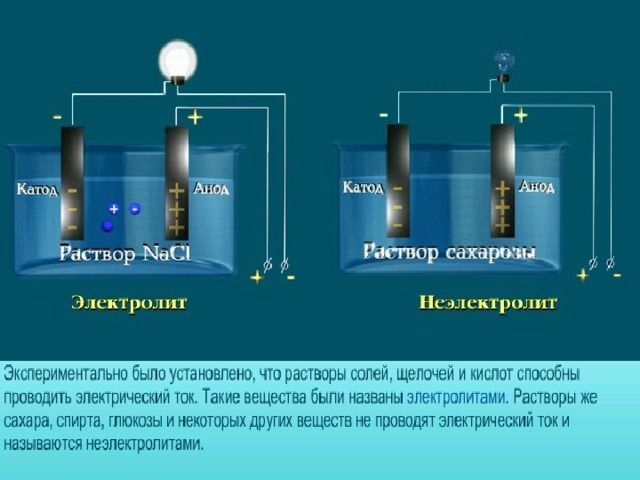
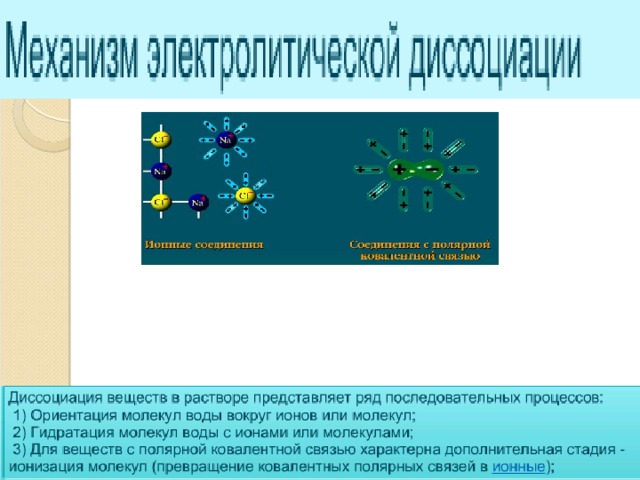
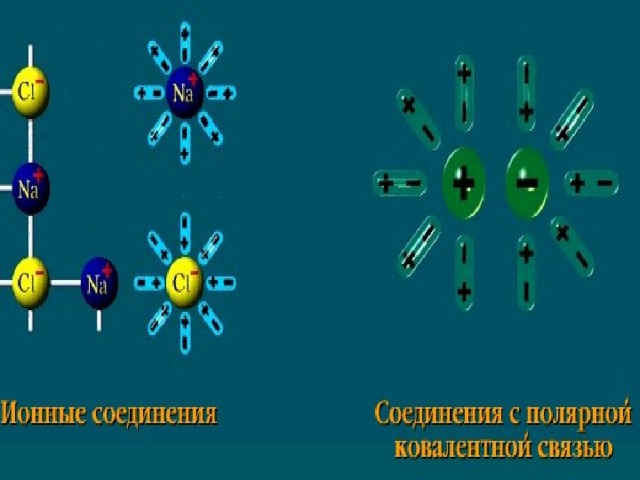
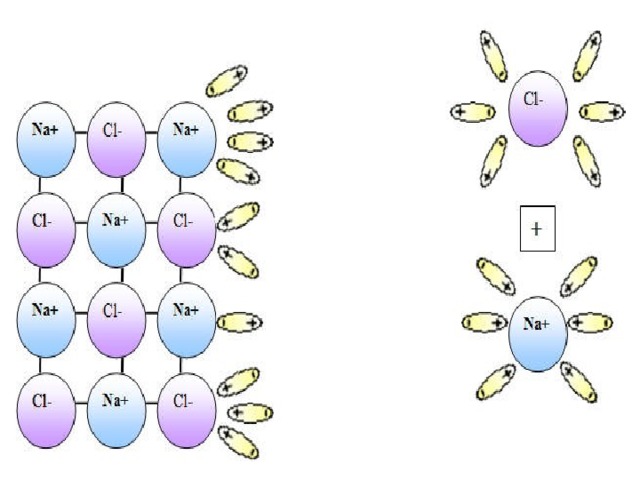
В презентации по химии для 8 класса раскрыта сущность "Теории электролитической диссоциации". Приводятся механизмы диссоциации ионных соединений и соединений с ковалентной полярной связью.
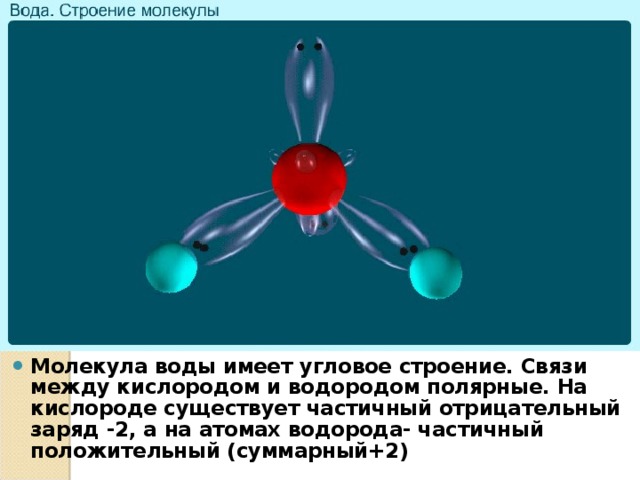
Объясняется строение молекулы воды. Молекула воды имеет угловое строение. Связи между кислородом и водородом полярные. На кислороде существует частичный отрицательный заряд -2, а на атомах водорода- частичный положительный (суммарный+2).
К электролитам относятся растворы кислот, оснований и солей. Кислоты- это электролиты, которые при диссоциации образуют катионы Н+ и анионы кислотных остатков. Н+ - это общее свойство всех кислот, поэтому они имеют:?кислый вкус,?похожие химические свойства, окрашивают лакмус и метиловый оранжевый в красный цвет.
Основания- это электролиты, которые при диссоциации образуют катионы Ме+ и анионы гидроксогруппы ОН-. ОН- это общее свойство всех оснований, поэтому они имеют:?мылкость растворов, похожие химические свойства, ?окрашивают метиловый оранжевый в желтый, лакмус в синий, фенолфталеин в малиновый цвет.
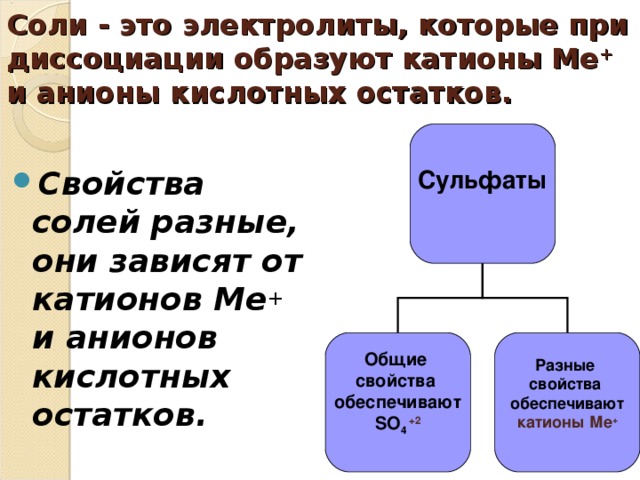
Соли - это электролиты, которые при диссоциации образуют катионы Ме+ и анионы кислотных остатков.?Свойства солей разные, они зависят от катионов Ме+ и анионов кислотных остатков.