Учитель химии
Ушакова Галина Григорьевна
Урок – игра «Покорение вершины».
Цел урока. Обобщить, систематизировать знания о химической связи, её видах и схемах образования; создать на уроке атмосферу поиска и сотрудничества.
Задачи.
Образовательные:
- продолжить развитие представлений о строении вещества;
- продолжать формировать понятие об электроотрицательности на основе знаний о строении атома, понятия химическая связь;
- обобщить знания о химической связи и ее видах;
- повторить знания о механизмах образования различных видов химической связи;
- способствовать развитию умений составлять электронные и структурные формулы соединений и объяснять механизм образования различных видов химической связи.
- продолжить формирование общеучебных умений (осуществлять самоконтроль; сотрудничать).
Развивающие:
продолжить формирование умений и навыков работы с ПСХЭ Д.И.Менделеева;
- развивать умение использовать химическую терминологию;
- развивать мыслительные операции (анализ, синтез, установление причинно-следственных связей, выдвижение гипотезы, классификация, проведение аналогий, обобщение, умение доказывать, выделение главного);
- развивать познавательную активность учащихся к предмету
- продолжить формирование идеи познаваемости мира;
- совершенствовать коммуникативные умения учащихся в совместной деятельности (умение вести диалог, выслушивать оппонента, аргументировано обосновывать свою точку зрения) и информационно - познавательную компетентность учащихся.
Воспитательные:
- способствовать формированию навыков культуры межличностного общения на примере умения слушать друг друга, анализировать ответы товарищей; аккуратно вести записи в тетради;
- воспитывать культуру речи, трудолюбие, усидчивость;
- продолжить формирование ответственного, творческого отношения к труду.
ОБОРУДОВАНИЕ: Учебные таблицы по теме, карта маршрутов, мультимедийный проектор.
Оформление доски. На доске написан эпиграф:
«Вопрос о природе химической связи - сердце всей химии».
(Брайк Кроунфорд – мл.)
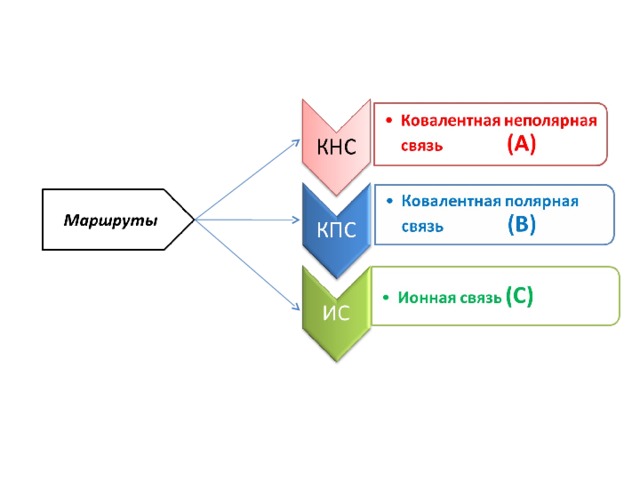
Доска разделена на три части в соответствии с маршрутами:
А – ковалентная неполярная связь (КНС); В – ковалентная полярная связь (КПС); С – ионная связь (ИС).
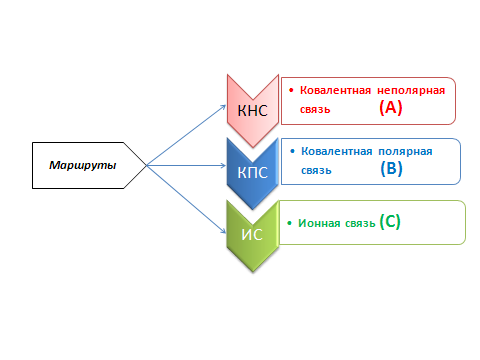 Условия игры: Урок проводится в форме экспедиции «Покорение вершины», где учащиеся перевоплощаются в спортсменов – альпинистов, покоряющих вершину знаний. Учащиеся разделены на группы, которые будут «двигаться» по трём маршрутам.
Условия игры: Урок проводится в форме экспедиции «Покорение вершины», где учащиеся перевоплощаются в спортсменов – альпинистов, покоряющих вершину знаний. Учащиеся разделены на группы, которые будут «двигаться» по трём маршрутам.

ЭТАПЫ МАРШРУТОВ:
II. Восхождение. LiBr
Выпишите KI
Формулы C
веществ: NaCl
А – с КНС; N2
В – с КПС; NH3
C – c ИС; Cu Изобразите
Na2O механизм об -
H2 разования свя-
H2S зи в веществах:
CO2 А – Cl2;
Br2 B – NH3;
H2O C – NaCl.
CaO
I. Собери рюкзак.
Дополните понятия:

 I
I

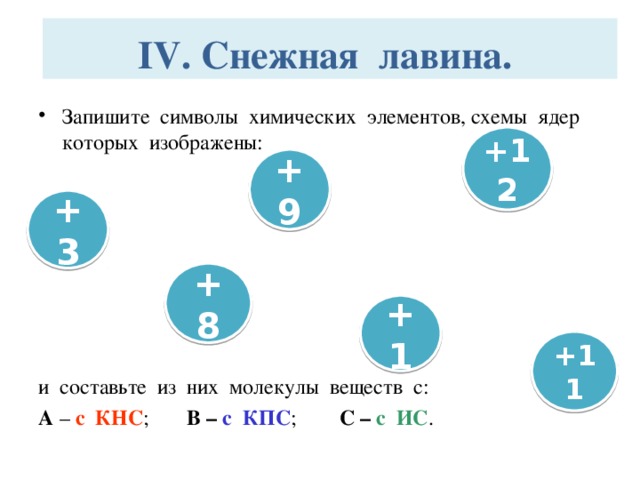
Снежная лавина.
Запишите символы химических элементов, схемы ядер которых изображены:
и составьте из них молекулы веществ с:
А – с КНС; В – с КПС;
С – с ИС.
III. Водопад веществ.
Составьте формулы веществ, образованных частицами X и Y, укажите вид связи:
X (1e) и Y (2e, 6e);
X (1s22s2p63s1) и Y (1s2)
+12X и +7Y;
X (Ba2+) Y (Cl-);
X (гл. п/гр. IV группы,2-й период)
и Y (гл. п/гр. VI группы, 2-й период.
+1
+11
+8
+12
+9
+3
V. В пещере отшельника
В пещере нашли старую рукопись, но она оказалась испорченной. Помогите её восстановить
1.0Li +3 )) +... ILi I+IF I-
2. :Br + Н …
3. … + N: : N N :Запишите схемы образования молекул с
А – с КНС;
В – с КПС;
С – с ИС.
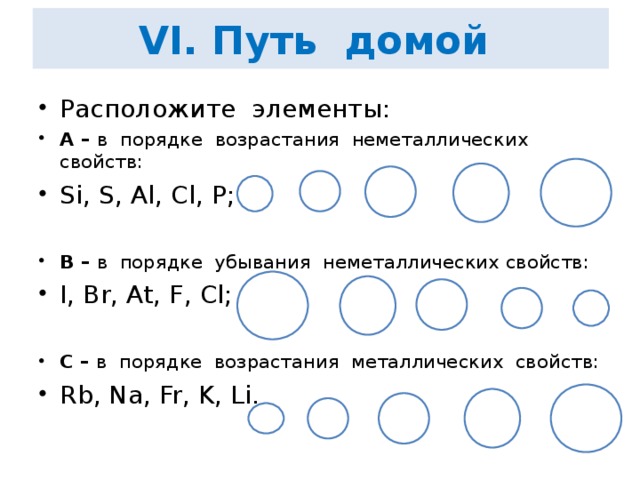
VI. Путь домой Расположите элементы:
А – в порядке возрастания неметаллических свойств:
Si, S, Al, Cl, P;
B – в порядке убывания неметаллических свойств:
I, Br, At, F, Cl;
C – в порядке возрастания металлических свойств:
Rb, Na, Fr, K, Li.





Домашнее задание. Путевые заметки.
Дополните записи, сделанные на уроке, примерами, выводами.
Обоснуйте свой выбор направления движения по маршруту.
Урок начинается с сообщения темы, которую учащиеся записывают в тетради. Уточняется цель урока, представляются друг другу группы учащихся, которые будут «двигаться» по соответствующим направлениям маршрута. Этапы маршрута с заданиями выводятся на экран.
Этап I. Собери рюкзак.
На этом этапе (с целью актуализации знаний) учащимся предлагается устно охарактеризовать некоторые понятия темы.

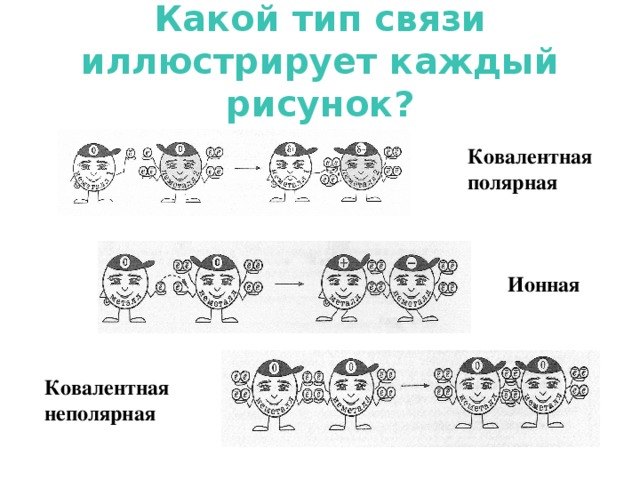
Примеры ответов: КПС – это вид связи, который образуется между атомами неметаллов разного вида; это вид связи, который образуется за счёт обобществления неспаренных электронов атомов различных неметаллов; КПС может осуществляться одной, двумя или тремя обобществлёнными парами электронов; и т.д.
При ответе учащиеся могут дополнять друг друга.
Более динамично и эффективно этот этап можно пройти с использованием Презентации №2

Этап II. Восхождение.
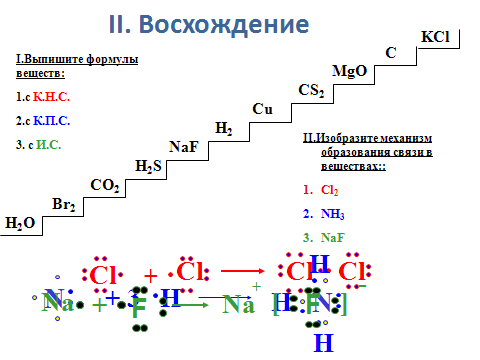
Учащиеся работают в парах, записывая ответ в тетради. По окончании выполнения этого задания осуществляем проверку, вызывая к доске представителей от каждой группы, которые оформляют и комментируют ответ.
Пример ответа: 1. H2O; CO2; H2S; NH3 – это формулы веществ с КПС, так как в составе указанных веществ – атомы разных неметаллов, электроотрицательность их различна; образование связи происходит за счёт обобществления неспаренных электронов.
H H
2. :N + H + H + H : N : H ; N – H
H H
На внешнем слое атома азота два спаренных и три неспаренных электрона. Каждый из трёх атомов водорода имеет один неспаренный электрон. Неспаренные электроны попарно обобществляются, образуя три связи в молекуле аммиака, при этом на внешнем слое атома азота остаётся неподелённая электронная пара.

Привал. Перед следующим этапом объявляем привал – проверяем домашнюю работу « химиков – лириков», которые пытались реализовать свои способности, представив сведения о строении атома и видах химической связи в стихотворной форме.
Этап III. Водопад веществ.

Ответ учащиеся оформляют в тетрадях, по мере готовности представитель от каждой группы выходит к доске и записывает его для фронтальной проверки, т.к. задание этого этапа общее для всех групп.
Пример ответа: Общее число электронов в атоме численно совпадает с порядковым номером химического элемента. Следовательно, атом X, в котором один электрон, - это водород, элемент главной подгруппы первой группы. Распределение электронов атома Y по слоям (2e, 6e) указывает на то, что это кислород, элемент главной подгруппы шестой группы, при взаимодействии атомов этих элементов между собой будет образовываться соединение H2O; вид связи – ковалентная полярная. 
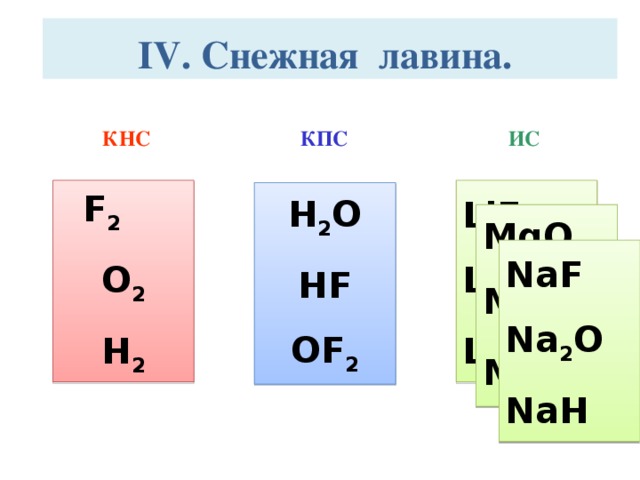
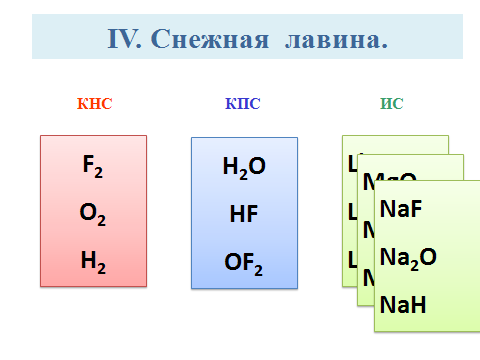
Этап IV. Снежная лавина.
Учащимся необходимо записать символы химических элементов, схемы ядер которых изображены и составить из них молекулы веществ с
А – с КНС; В – с КПС; С – с ИС.

Пример ответа: Заряд ядра атома химического элемента численно совпадает с его порядковым номером, следовательно, изображены ядра следующих химических элементов: Li, F, Mg, O, Na, H. Среди них неметаллы: F, O, H. Атомы данных химических элементов могут образовать молекулы следующих веществ: H2O; HF; OF2.
Например:
H + F H : F : ; H – F
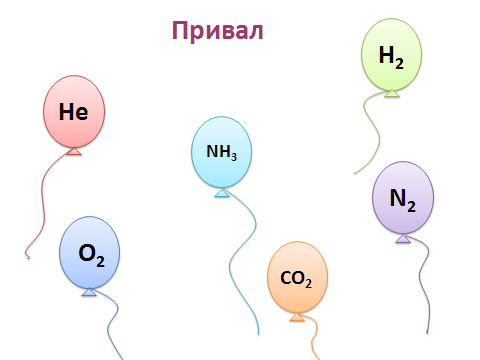
После этого задания объявляется привал.
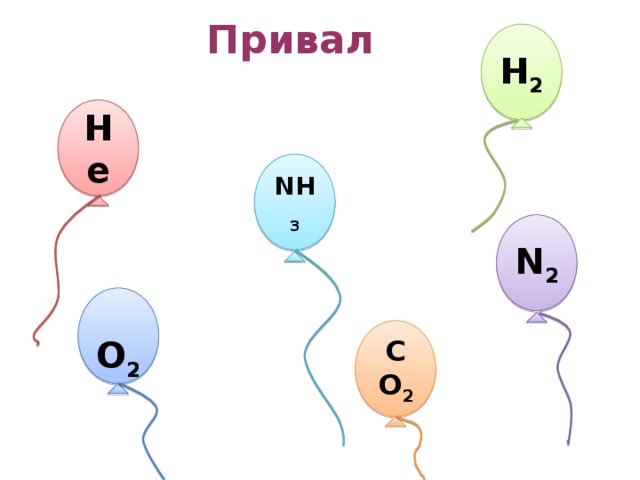
Привал: Каким газом заполнен шарик?
На слайде изображены разноцветные воздушные шарики, размещённые на различной высоте. В течение нескольких минут учащиеся должны определить, каким газом из тех, чьи формулы записаны ниже, заполнен каждый шарик. Какой вид связи характерен для молекул газа, которым заполнен шарик, расположенный выше других.
N2, NH3, CO2, H2, He, O2.

Этап V. В пещере отшельника.
Восстанавливая «старую рукопись», учащиеся восполняют в ней пропуски, дописывая атомы или молекулы соответствующих веществ. У доски работают по одному представителю от каждой группы.

Пример ответа. КПС образуется между атомами разных неметаллов. Этому соответствует схема №2. В результате взаимодействия атома H c атомом Br образуется молекула HBr.
H. + .Br: H:Br
Этап VI. Путь домой.
Для выполнения этого задания учащиеся работают с ПС и повторяют вопрос о закономерностях изменения металлических и неметаллических свойств у химических элементов, расположенных в одной подгруппе или одном периоде. Работа выполняется всей группой, а комментирует один из учащихся данной группы.

Пример ответа. Элементы: I, Br, At, F, Cl расположены в 7 группе главной подгруппе, -это неметаллы. В группе неметаллические свойства (с возрастанием порядкового номера) убывают, следовательно, элементы, согласно заданию, должны расположиться в следующем порядке: F, Cl, Br, I, At.
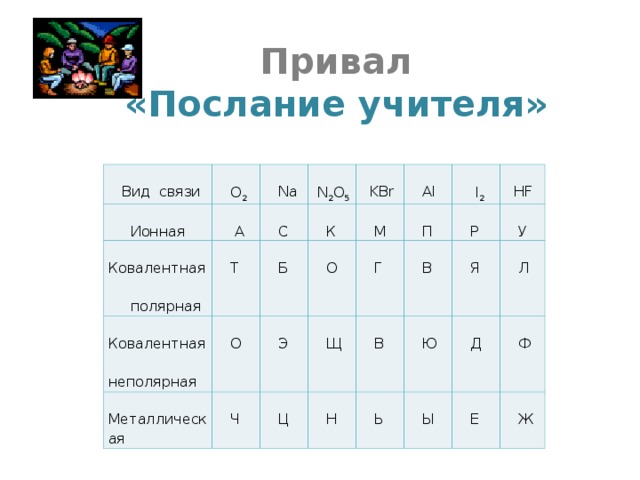
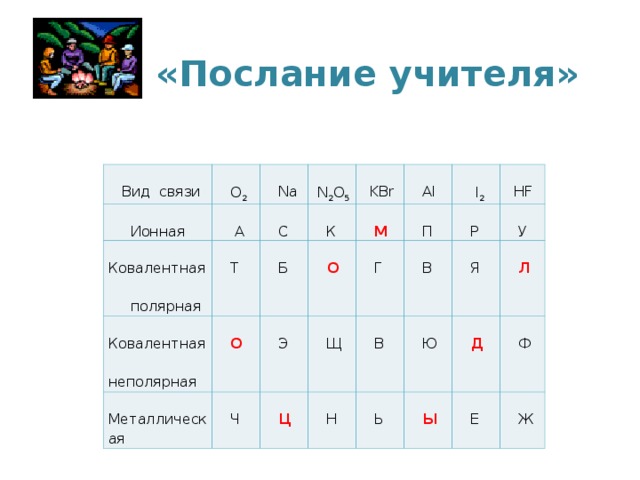
Привал. Послание учителя.
На последнем этапе учащиеся должны прочитать зашифрованное в таблице слово. Дополнительный бал получает группа, которая первой прочтёт слово молодцы.
| Вид связи | O2 |
Na |
N2O5 |
KBr |
Al |
I2 |
HF |
| Ионная |
А |
С |
К |
М |
П |
Р |
У |
| Ковалентная полярная |
Т |
Б |
О |
Г |
В |
Я |
Л |
| Ковалентная неполярная |
О |
Э |
Щ |
В |
Ю |
Д |
Ф |
|
Металлическая |
Ч |
Ц |
Н |
Ь |
Ы |
Е |
Ж |
Домашнее задание («Путевые заметки») позволит учащимся уточнить и дополнить записи, сделанные на маршруте.
Дополнительное задание (по желанию) – заполнить кроссворд.
Итог урока.
В конце урока подводятся итоги: группы оценивают работу друг друга, выявляются наиболее активные ученики, даётся оценка их работы. Отметки за урок получают также учащиеся, которые отвечали у доски и те, которые приготовили стихотворения.
Если на первом привале прозвучит мало стихотворений, или учащиеся совсем не справятся с этим заданием, то можно им предложить рубрику «Химия в стихах».
Ионная связь
Встретились как-то Литий и Фтор.
Литий со Фтором вели разговор:
- Братец металл мой, послушай совет:
Свой электрончик отдай для октета.
Сам ты при этом станешь ионом –
Слой предыдущий вполне завершённый,
Только протонов в ядре твоём три –
Весь положительный будешь, смотри!
Литий пред Фтором стоял в размышленье,
Чувствуя силу его притяженья –
Радиус атома у галогена
Меньше гораздо металла размера.
- Разница слишком большая в Э.О.,-
Литий вздохнул и отдал электрон. –
Пользуйся, Фтор, будет мне поделом,
Знал, что нельзя быть таким «толстяком».
Только теперь ты тоже не атом,
Ты отрицательный, братец, ион!
И улыбнулись друг другу они,
В связи ионной вместе пошли.
Задание к стихотворению: поясните подчёркнутые словосочетания.
О ХИМИЧЕСКИХ ЭЛЕМЕНТАХ И ВЕЩЕСТВАХ.
Сера
В доступной форме и манере
Поговорим о жёлтой сере:
Типичный хрупкий неметалл,
Октаэдрический кристалл.
По берегам великой Волги
И вдоль её притоков долгих
Запас свободной серы есть –
Богатств российских нам не счесть!
Да, сера в виде самородка –
Довольно ценная находка.
Она нужна, как знаешь ты,
Для производства кислоты.
До пыли измельчённой серой,
Известную как серный цвет,
Уничтожают тлю, к примеру,
Предотвращая страшный вред.
Известно, каучук в морозы
Обычно хрупок как стекло.
В жару другая есть угроза:
Размякнет он – и потекло!
Но чтобы изменить картину,
Нагреют с серой каучук,
И вот, пожалуйста, - резина,
И свойства изменились вдруг.
Хлор
Что слово «хлор» обозначает?
Зеленовато-жёлтый цвет.
Хлор из хлоридов получают,
Хлор ядовит, хлорида – нет.
Газ не встречается в природе,
Но входит хлор в состав солей.
Растворены хлориды в водах
Всех океанов и морей.
В любой солонке из фарфора,
Что на обеденных столах,
Ионы натрия и хлора
Есть в кристаллических узлах.
Хлор повсеместно применяют
Для дезинфекции воды:
Микробов вредных истребляют,
Людей спасают от беды.
Аргон
Аргон – бесцветный, благородный,
Инертный, как и гелий, газ.
Для уличных реклам пригодный,
Что всюду окружают нас.
Для сине-голубой подсветки
Его используют нередко.
Пройдя аргоновый поток,
Стал видимым электроток.
Используемая литература:
О. С. Габриелян. Химия. 8 класс:
Учебник для общеобразоват. учеб. заведений. – М.: Дрофа, 2009.
М. Ю. Горковенко. Химия. 8 класс: Поурочные разработки по химии. – М.: ВАКО, 2004.
А. Ю. Гранкова. Химия: 8 класс: Методическое пособие для учителя. – М.: ООО «Издательство АСТ»: ООО «Издательство Астрель», 2002.
О. С. Габриелян. Химия. 8 класс: Рабочая тетрадь к учебнику О. С. Габриеляна «Химия. 8.» - М.: Дрофа, 2009.
Методический журнал «Химия в школе» № 4 2004 год.
Презентация №2
(Хисматулин Е. В., учитель химии МОУ СОШ № 8 п. Спирово Тверской обл)
13



 Условия игры: Урок проводится в форме экспедиции «Покорение вершины», где учащиеся перевоплощаются в спортсменов – альпинистов, покоряющих вершину знаний. Учащиеся разделены на группы, которые будут «двигаться» по трём маршрутам.
Условия игры: Урок проводится в форме экспедиции «Покорение вершины», где учащиеся перевоплощаются в спортсменов – альпинистов, покоряющих вершину знаний. Учащиеся разделены на группы, которые будут «двигаться» по трём маршрутам. 






















![II. Восхождение KCl C I.Выпишите формулы веществ: 1.с К.Н.С . 2.с К.П.С. 3. с И.С. MgO CS 2 Cu H 2 II.Изобразите механизм образования связи в веществах:: Cl 2 NH 3 NaF NaF H 2 S CO 2 Br 2 H 2 O H Cl Сl Cl Сl + - + N + 3 H N H [ ] Na Na + F F H](https://fsd.kopilkaurokov.ru/uploads/user_file_548199a882b1d/img_user_file_548199a882b1d_0_8.jpg)