|
| Этап урока | Задача, которая должна быть решена (в рамках достижения планируемых результатов работы) | Формы организации деятельности учащихся | Действия педагога по организации деятельности учащихся | Действия учащихся | Результат взаимодействия учителя и учащихся по достижению планируемых результатов урока | Диагностика достижения планируемых результатов урока |
| 1. | Организационный момент | Создание условий осознанного вхождения учащихся в деятельность на уроке. | Фронтальная | На предыдущем уроке мы рассмотрели химические свойства солей, т.е.закономерности их взаимодействия с растворами кислот, щелочей и других солей. На сегодняшнем уроке мы познакомимся еще с одним важнейшим, но пока еще не известным вам свойством солей. Учитель просит учащихся проанализировать содержание заданий инструктивных карт и высказать свои предложения. | Ученики слушают. Проверяют готовность инструктивных карт и оборудования к уроку.
Ответы учащихся. | Л: воспринимать речь учителя, выражать положительное отношение к процессу познания Р.нацеливание на успешную работу К: аргументировать свои суждения |
|
| 2. | Актуализация знаний
| Повторение изученного материала, необходимого для «открытия нового знания».
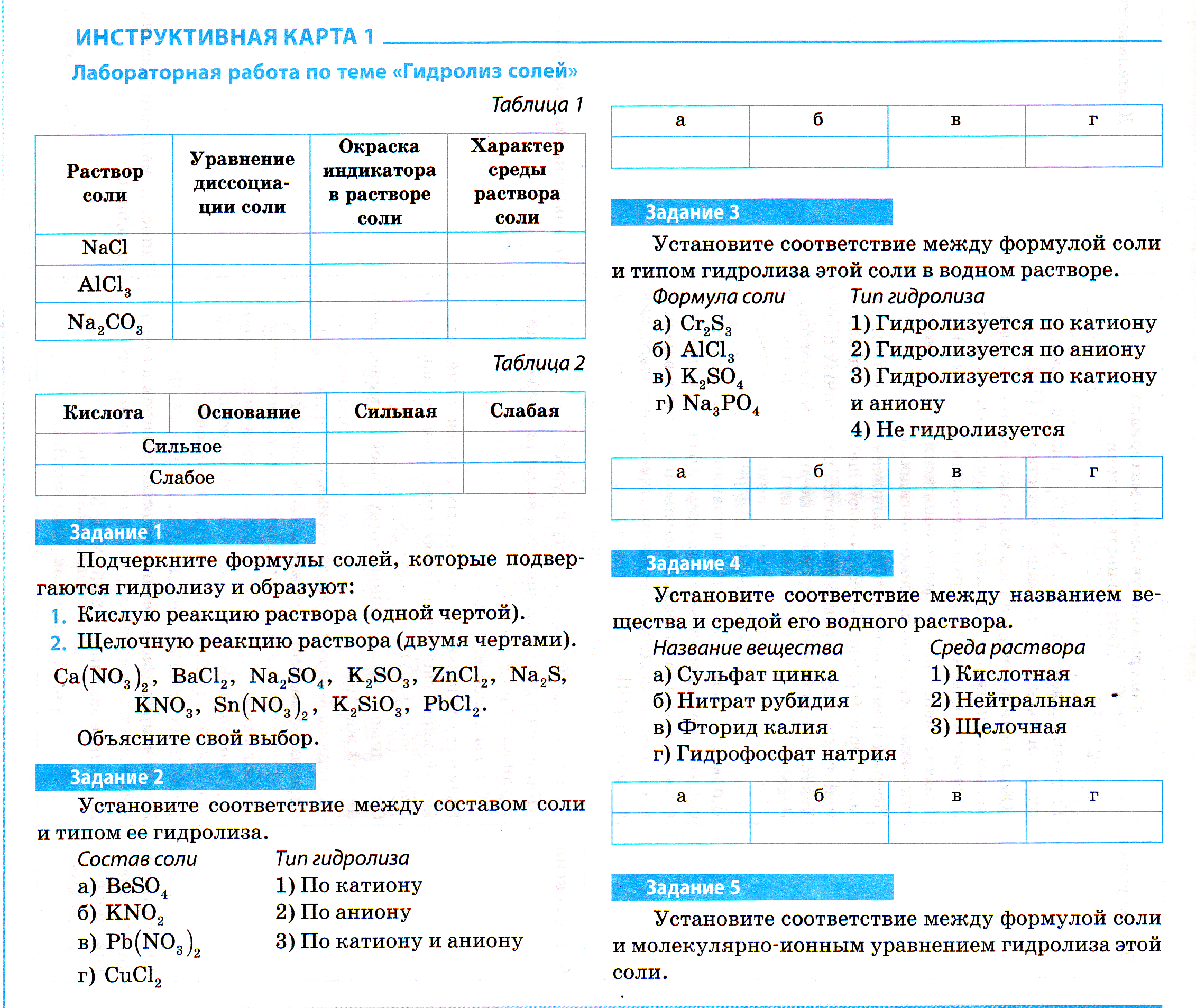
| Фронтальная | Организует работу по повторению изученного материала. Вопросы для беседы: Как определяется состав средних солей? Каковы способы получения солей? На какой из этих способов получения солей мы обращали наибольшее внимание? Можно ли считать эти схемы отражающими процесс получения солей? NaOH +HCl= Al(OH)3 +HCl= NaOH +H2O+CO2=
Запишите уравнения этих реакций в молекулярном и ионном видах. Как называются эти реакции? Почему? Учитель: Однако когда речь ведут о растворах, в действие вступают законы электролитической диссоциации. Подтвердятся ли наши предположения о характере растворов солей с точки зрения этой теории? В: Что происходит с солями при их растворении в воде? Запишите в таблицу 1 (см.приложения) уравнения диссоциации солей, образующихся в результате вышезаписанных реакций. Является ли признаком химической реакции изменение окраски индикатора? Почему? Какие ионы обнаруживабтся в растворах с помощью индикатора? Образуются ли этиионы при диссоциации ранее рассмотренных солей? Учитель. Но чтобы до конца быть объективными, любые теоретические рассуждения подтверждаются практическим экспериментом. Определите индикаторм характре предложенных растворв солее и заполните таблицу 1 (см.инструктивную карту). Прокомментируйте полученные результаты. | Отвечают на вопросы учителя. Три ученика у доски, остальные-в тетрадях. Формулируют и записывают вывод: реакция нейтрализации названа так потому, что действие кислоты нейтрализуется действием основания, и, следовательно, соли в растворе имеют нейтральную среду. Отвечают на вопросы учителя. Формулируют и записывают вывод: ТЭД тоже подтверждает нейтральность среды в растворах солей. Выполняют лабораторный опыт. Заполняют таблицу в инструктивной карте. Формулируют и записывают вывод: опыт вступает в противоречие с рассмотренными ранее теориями. В реальности растворы солей наряду с нейтральной могут иметь и кислую, и щелочную среду, хотя и не образуют при диссоциации ни катионы водорода, ни гидроксид-ионы
|
К: формирование умения ясно и чётко излагать свою точку зрения. П: анализ объектов. Р: контроль, коррекция; прогнозирование |
|
| 3. | Целеполагание (выход на тему урока и цель совместно с учащимися)
| Формирование цели учениками. | Фронтальная | В: С чем связано это явление? От чего оно зависти? Учитель помогает сформулировать гипотезу, проблему урока. | Отвечают на вопросы учителя Формулируют проблему, гипотезу, цели и задачи урока. Проблема урока: почему растворы солей изменяют окраску индикатора? Гипотеза: если растворы изменяют окраску индикатора, значит, в них присутствуют катионы водорода или гидроксид-анионы. Цель урока: выяснить механизм образования катионов водорода и гидроксид-анионов в растворах солей. Тема урока. Взаимодействие ионов соли с молекулами воды-гидролиз солей. Задачи урока: - научиться определять среду раствора соли; - научиться записывать уравнения реакций гидролиза солей | П:умение структурирровать знания К:оформлять свои мысли в устной форме Р:определять и формулировать тему, цель и задачи на урок с помощью учителя
|
|
| 4. | Изучение нового материала
| Организация коммуникативного взаимодействия | Фронтальная
| Организует учащихся на исследование проблемной ситуации Рассказ. Чуть раньше мы с вами отметили, что изменение окраски индикаторов является признаком химической реакции, и именно этот признак вы наблюдали при проведении лабораторного опыта. А поскольку во всех трех случаях мы имели с вами систему соль+вода, следовательно, именно между этими веществами и осуществлялось взаимодействие, приводящее к накоплению катионов водорода или гидроксид-ионов. Вопросы: _попробуйте проанализировать состав исследуемых солей на основании уравнений реакций их получения и заполните таблицу 2 (см.инструктивную карту 1). Прокомментируйте свои записи. _Ионами каких электролитов образованы соли, создающие кислую и щелочную среду раствора? | Составляют план достижения цели и определяют средства. Слушают учителя. Отвечают на вопросы Формулируют и записывают вывод: среда раствора солей зависти от их состава. | К: планирование учебного сотрудничества. Формирование умения осуществлять выбор, формирование умения работать в группах. П: развитие операций мышления, поиск и выделение информации. Л: формирование уважения к иному мнению. Р: планирование, волевая саморегуляция. Умение оценивать свою деятельность. К:оформлять свои мысли в устной форме.
|
Зафиксированное учебное действие, оценка собственной деятельности |
| 5. | Физминут- ка
| Предупредить и снять умственное и физическое утомление | Фронтальная. | А теперь ребята, я предлагаю немного отдохнуть | Выполняют зарядку для тела и глаз.
|
|
|
| 6. | Продолже-ние изучения темы | . |
| Учитель организует реализацию построенного проекта в соответствии с планом Учитель: А теперь давайте подробнее рассмотрим, в чем заключается взаимодействие между солью и водой и почему состав соли играет в этой реакции основополагающую роль. Учитель. Итак, при проведении реакций с растворами солей необходимо учитывать возможность гидролиза. При составлении уравнений гидролиза надо помнить, что эти реакции обратимые, за исключением солей 3-го типа. Гидролиз солей при обычных условиях идет только по первой ступени. В: -Что же такое гидролиз? -Что образуется в процессе гидролиза? | Слушают учителя. Делают записи в тетради.  |
Учащиеся анализируют работу |
|
| 7. | Подведение итога | Осознание учащимися своей учебной деятельности.
| Фронтальная
Индивидуальная
Групповая | Учитель предлагает для усвоения материала выполнить задание 1 в инстркутивной карте. Прокомментировать ответ.
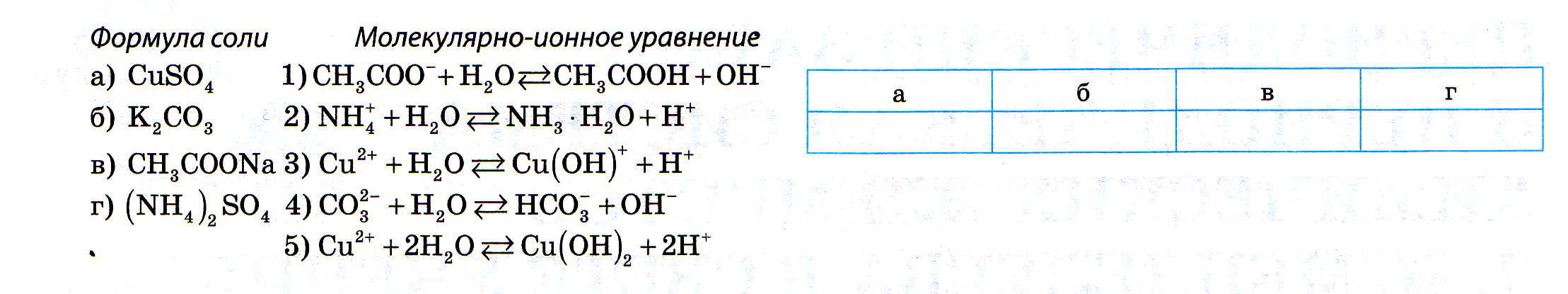
Учитель организует самостоятельное выполнение учащимися заданий 2-5 в инструктивных картах Учитель. Прочитайте текст (см. Инструктивная карта 2) Выполните любое из предложенных заданий. Объясните свое решение | Выполняют задания из инструктивных карт. Комментируют свой ответ.
Самостоятельно выполняют задание в течение 2-3 минут. Осуществляют самопроверку по эталонам ответов.
Учащиеся выполняют задание. Обсуждают ответы товарищей.
| Л: формировать способность к самооценке на основе критерия успешности учебной деятельности |
|
| 8. | Рефлексия учебной деятельнос-ти на уроке
| Проверка способности самооценки, как личностного результата.
| Индивидуальная
|
Подведем итоги наших исследований и я попрошу оценить вашу работу на уроке. Оцените урок: - понравился - мне все равно - не понравился
|
Оценивают свою работу на уроке.
| Л: формировать способность к самооценке на основе критерия успешности учебной деятельности К:оформлять свои мысли в устной форме К: формулировать собственное мнение и позицию;
| Самооценка учащихся с помощью смайликов |
| 9. | Домашнее задание |
| Фронтальная | Дома: задание в учебнике п.18. зад.3,4 | Слушают инструктаж по выполнению домашнего задания. | Л: готовность целенаправленно использовать знания, умения и навыки в учебной деятельности и в повседневной жизни |
|
Обменные реакции между солями и водой широко распространены в природе.
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. (опишите это процесс на примере сульфида алюминия) В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод рН прибл. равно 9 наиболее интенсивно протекает фотосинтез в морских растениях, и наиболее быстро развиваются морские животные. А если вспомнить о составе рН крови млекопитающих, в том числе и человека, то вы сможете не только сделать вывод о единстве животного мира на Земле но и сформулировать и некоторые гипотезы происхождении жизни на планете.
Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 оС и выше происходит интенсивное взаимодействие указанных хлоридов с водяным паром. Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого сделано оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов.
Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань, и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится.
Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкоза, сухой лед.
В повседневной жизни мы постоянно сталкиваемся с явлением гидролиза – при стирке белья, мытье посуды, умывании мылом. Даже процессы пищеварения, в частности, расщепление жиров, протекают благодаря гидролизу.