| Актуализация знаний 2 минуты
Проверка д.з. 10 мин | Приветствие. На предыдущем уроке вы получили домашнее задание повторить понятия электролиты, их классификацию и уравнения диссоциации, индикаторы и их применение. По желанию составить слайды со схемами или таблицами отражающими эти понятия и прислать мне на эл адрес. Зачем? Вы ведь все это изучали в 8 классе. Зачем, как вы считаете, я Вас очень просила выполнить д.з.? и обещала спросить?
По ходу урока, Вы будете получать баллы за ответы. В конце урока, набравшие 4, 5 баллов получают соответствующие оценки, 3 поставлю по желанию и на свое усмотрение. Все кто прислал слайды, спасибо, получаете 4 балла Те, кто подробно повторял понятия, надеюсь, Что это сделали все, по желанию (или по журналу, если желающих нет) выходят к доске. С помощью слайдов, которые я решила использовать, и которые я буду включать вам необходимо раскрыть понятия д.з. Очень прошу внимательно отнестись к информации, потому что, только так вы сможете понять новую тему, написать к.р. почувствовать себя успешным, получить положительные эмоции.
| Отвечают, сами или с помощью учителя, что эти знания обязательно нужны для понимания новой темы
Самостоятельно или с помощью учителя, раскрывают понятия если не помните материал, кратко записываете в тетрадь содержание слайдов
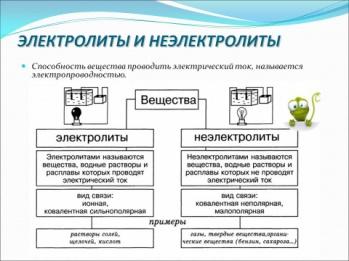
| Определения
Слайды:
| Личностные коммуникативные Регулятивные
Личностные Коммуникативные Регулятивные
|
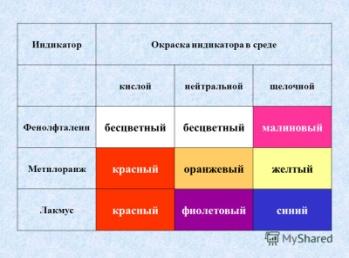
| Создание проблемной ситуации 8 минут | 1.От чего зависит цвет индикатора? 2. Чем отличается кислая среда от щелочной? Подсказка на слайде, обратите внимание. 3. Обратим еще раз внимание, какие ионы образуются при диссоциации кислоты, щелочи? 4. Предположите, каким будет воздействие индикатора на растворы средних солей. Какой будет цвет индикатора, какая среда раствора? Обращает внимание на продукты диссоциации, это металл и кислотный остаток. 5. Демонстрация опыта В первом случае нейтральная, во втором кислая в третьем щелочная 6. Почему? 7. Откуда катионы водорода, гидроксид анионы? В растворах солей? Обратите внимание на диссоциацию воды 8. Почему в первом случае нейтральная, во втором кислая в третьем щелочная среда раствора?
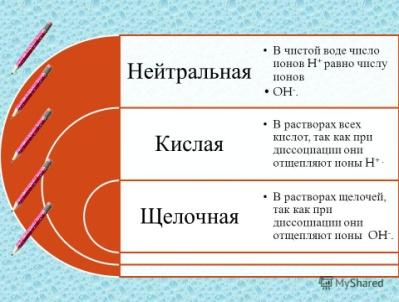
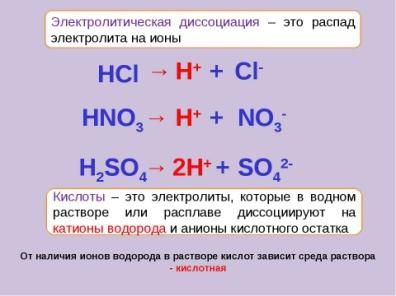
| Отвечают, сами или с помощью учителя 1. От того, какая, кислая или щелочная среда 2.В кислой, преобладают катионы водорода. В щелочной – анионы гидроксогрупп 3. При диссоциации, кислот - катионы водорода и анионы кислотных остатков. Щелочей – анионы гидроксогрупп и катионы металлов. 4.Предполагают, что среда раствора - нейтральная.
5. При демонстрации первого опыта подтверждается, и не подтверждается при проведении второго и третьего опыта. 6. Затруднение 7. Катионы водорода, гидроксид анионы образуются при диссоциации воды. 8. Затруднение
|
| Коммуникативные Регулятивные Познавательные
|
| Формулирование проблемы (темы и целей урока) 2 мину ты | Вопрос: Какая цель, чему мы должны научиться?
Как может называться тема урока? Запишите в тетрадь: Тема "Гидролиз средних солей "
| Ответ: цель выяснить, почему индикаторы в растворах разных солей показывают кислую, щелочную, или нейтральную среду. Название процесса, который происходит при растворении средних солей. Записывают тему |
|
Регулятивные Коммуникативные
|
| Открытие нового знания 2 минуты | От чего зависят свойства веществ?
| От их строения. Нужно выяснить чем отличаются средние соли по составу. | 
| Регулятивные Познавательные |
| Формулирование нового знания минут | 1.Представим среднюю соль, как часть кислоты и основания 2.Кислота и основание могут быть слабым или сильным электролитом 3.В растворе ионы слабого электролита входящего в состав соли, соединяются с ионами воды и остаются в виде молекул 4.В растворе ионы сильного электролита входящего в состав соли, не соединяются с ионами воды и остаются в виде ионов
Как зависит среда раствора от состава средней соли?
Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц
|
Заполняют табличку (чернный)
Предполагаемые ответы: Если составляющими средней соли является сильный электролит основание, и слабый электролит – кислота, в растворе остаются анионы гидроксогрупп, катионы водорода связываются в молекулы слабого электролита - кислоты, и среда становится щелочная. Если составляющими средней соли является сильный электролит кислота, и слабый электролит – основание, в растворе остаются, катионы водорода, анионы гидроксогрупп связываются в молекулы слабого электролита - основания, и среда становится кислой. Записывают определение |
| Основание | Кислота | Соль | | KOН | НNO3 | K NO3 | | KOН | НNO2 | KNO2 | | Cu (OН)2 | НNO3 | Cu (NO3)2 | | Cu (OН)2 | НNO2 | Cu (NO2)2 |
| Основание | Кислота | Соль | | KOН с. | НNO3 с. | K NO3 | | KOН с. | НNO2 сл. | KNO2 | | Cu(OН)2 сл. | НNO3 с. | Cu (NO3)2 | | Cu (OН)2 сл. | НNO2 сл. | Cu (NO2)2 |

| Регулятивные Познавательные Коммуникативные
|
| Первичное применение нового знания 3 минуты | Предлагает задание: Верно ли Выражение о гидролизе средних солей? Что сильнее (кислота или щелочь) - такая и среда | Объясняют, почему выражение верно | Что сильнее (кислота или щелочь) - такая и среда | Коммуникативные Регулятивные Познавательные
|
| Самостоятельная работа 7 минут | Предлагает задание. Зная как на среду раствора влияет состав средней соли, предлагаю определить среду растворов солей в таблице | Самостоятельно или с помощью учителя заполняют в колонку соли в таблице |
| Основание | Кислота | Соль | | KOН сильн. электролит | НNO3 сильн. электролит
| K NO3 соль сильного основания и сильной кислоты, поэтому гидролиз не протекает Нейтральная среда | | KOН сильн. электролит | НNO2 слаб. электролит
| KNO2 гидролиз по аниону (в реакцию с водой вступает только анион) Кислая среда | | Cu (OН)2 слаб. электролит
| НNO3 сильн. электролит | Cu (NO3)2 гидролиз по катиону (в реакцию с водой вступает только катион) Щелочная среда | | Cu (OН)2 слаб. электролит | НNO2 слаб. электролит
| Cu (NO2)2 совместный гидролиз (в реакцию с водой вступает и катион, и анион) гидролиз протекает практически полностью, оба продукта реакции реакции в виде осадка и газа |
| Познавательные Регулятивные |
| Рефлексия Итог урока 3 минуты | Пригодилось ли Вам домашнее задание при изучении новой темы? Как и когда Вам стало это понятно? Мы достигли цель?
Уточнят баллы и оценки учащихся | Отвечают, почему знания из д.з. были обязательно нужны для понимания новой темы. Мы достигли цель, выяснили, почему индикаторы в растворах разных солей показывают кислую, щелочную, или нейтральную среду.
|
| Регулятивные Коммуникативные
|
| Домашнее задание 1минута | Задает задание на дом
| Записывают Дом. Задание Задают вопросы | 1 . Обязательно: выучить определения гидролиз, типы гидролиза. Напишите 10 формул солей, и среду раствора.
2 . Дополнительно Всегда ли при совместном гидролизе среда нейтральная, почему? Попробуйте записать уравнение реакции гидролиза. | Регулятивные Коммуникативные
|



























