Муниципальное общеобразовательное бюджетное учреждение
средняя общеобразовательная школа №1 г. Мелеуз
Муниципального района Мелеузовский район Республики Башкортостан
Урок в 11 классе на тему:
«Химия и повседневная жизнь».
Подготовила и провела:
Учитель химии высшей
квалификационной категории
Плисова Антонина Николаевна
Мелеуз, 2015
Цели урока:
повысить интерес обучающихся к изучению химической науки;
познакомить обучающихся с безопасной химией, используемой в быту.
Задачи урока:
Образовательная: рассмотреть с точки зрения химии некоторые химические вещества, используемые в быту.
Развивающая: формировать умение правильного использования химических веществ в повседневной жизни;
Воспитательная: ответственное отношение к своему здоровью.
Тип урока: комбинированный.
Междисциплинарные связи: биология, основы безопасности жизнедеятельности.
ХОД УРОКА
1. Организационный момент.
2. Мотивация учебной деятельности. Сообщение темы, цели занятия.
1. Вступительное слово учителя
Уважаемые ребята! Наш урок посвящен теме “Химия и повседневная жизнь человека”
В любой отрасли человеческой деятельности, следовательно, в любой профессиональной деятельности, связанной с материальным миром, мы неизбежно соприкасаемся с веществами и используем их свойства и взаимодействие между собой. Химия, обладая огромными возможностями, создает невиданные ранее материалы, умножает плодородие почвы, облегчает труд человека, экономит его время, одевает, сохраняет его здоровье, создает ему уют и комфорт, изменяет внешность людей. Использование людьми достижений современной техники и химии требует высокой общей культуры, большой ответственности и, конечно, знаний. Именно с этой целью мы проводим этот урок и, надеюсь, он будет интересен и полезен также тем, кто считает химию скучным, бесполезным для себя школьным предметом , далеким от повседневной жизни обычного человека .В повседневной жизни человек использует большое количество веществ. Совершим путешествие по квартире и посмотрим, что мы используем.
3. Освещение учебного материала.
Домашняя аптечка.
Сейчас, наверное, в каждой семье есть необходимая аптечка. А как же иначе? Ведь не набегаешься к врачу каждый раз, когда поцарапала кошка, случился ожог от утюга или в палец попала заноза. В домашней аптечке обычно бывают самые простые средства для дезинфекции и перевязки, для того чтобы остановить кровь при порезах или царапинах, для полоскания горла при начинающейся простуде. Это химические вещества с интересными свойствами.
Какие химические вещества и для чего мы используем дома?
KMnO4 - марганцовка или перманганат калия – одна из самых загадочных химических «натур». Демонстрация растворов марганцовки свежеприготовленного и старого.
Перманганат калия в твердом виде – хорошо растворимые в воде кристаллы (демонстрация порошка марганцовки) черно фиолетового цвета. Разбавленные водные растворы этого вещества – розового цвета, они неустойчивы и под действием солнечных лучей разлагаются с образованием бурого осадка диоксида марганца MnO2 и выделением кислорода: записываем реакцию и расставляем коэффициенты методом электронного баланса.
4KMnO4 + 2H2O = 4KOH + 4MnO2↓ + 3О2
Не зря химики прошлого назвали этот раствор «хамелеоном». А первооткрывателем этого удивительного представителя «химического животного мира» был Карл Вильгельм Шееле – по основной своей должности аптекарь. Перманганат калия сильный окислитель, это дает возможность использовать его в лечебных целях – для уничтожения всякой инфекции, для «прижигания и подсушивания» кожи и слизистых оболочек.
Марганцовка, разлагаясь, выделяет активный кислород, а это ярый враг микробов и неприятных запахов. Интересно, что зачастую кислород выделяется (и мгновенно используется в реакциях окисления), не успевая образовывать газовые пузырьки. Это позволяет врачам вводить раствор перманганата в глубокие раны при очень опасной анаэробной инфекции. Пишем уравнение реакции разложения перманганата. (Расставляем степени окисления). 2KMnO4 = K2MnO4+ MnO2+О2.
Прекрасная перекись.
Кроме марганцовки хорошим окислителем является пероксид водорода - отличный антисептик.
Действительно пероксид водорода H2O2 – один из постоянных обитателей домашней аптечки. Его как лекарственное средство используют чаще всего в виде 3%-ного водного раствора. При контакте с живыми тканями пероксид водорода разлагается с выделением кислорода, отсюда и противомикробное действие. Разбавленные растворы пероксида водорода используют как кровоостанавливающее и дезинфицирующее средство: фермент крови расщепляет H2O2 на воду и активный кислород, который надежно обеззараживает рану. Однако действие его кратковременно, поэтому, остановив кровотечение, надо обработать рану по всем правилам и наложить повязку.
Для чего нужен йод?
Сейчас трудно поверить, но йод не находил никакого применения в медицине. Лечебные свойства йода оказались при «деле» только во время крупных народных несчастий и бед. Это была крымская военная кампания 1853-1856г, а потом русско-японская война 1904-1905гг. сначала военные врачи начали использовать синий порошок – сухой йодокрахмал, им лечили даже дезинфекцию. В 1904 году русский военный врач Филончиков ввел в практику работы полевого госпиталя спиртовые растворы йода для обработки ран. Современная йодная настойка, кроме йода, содержит иодид калия, этиловый спирт и воду. Зачем в йодную настойку добавляют иодид калия? Дело в том, что чистый йод в воде почти не растворим, а иодид калия образует с йодом хорошо растворимый буро-коричневый комплекс: KI + I2 = K(I3)
Химчистка.
Но если вдруг случилась неприятность, и вы пролили йод, то и здесь вам поможет химия.
От пятна с йодом можно избавиться сульфитом натрия.
Опыт: на ткань капнем каплю йода и потом раствором сульфита натрия. (Пишем уравнение ОВР между йодом и сульфитом натрия в щелочной и нейтральной среде и расставляем коэффициенты методом электронного баланса).
Сообщение на тему: Удаление пятен разными способами.
Косметика и химия.
Письменные источники, раскопки древних поселений свидетельствуют о том, что на ранней стадии развития общества к раскрашиванию тела были неравнодушны и мужчины и женщины. У мужчин это особенно проявлялось в склонности к татуировке, а женщины подкрашивали веки, брови, губы, щеки. Естественно, что в далеком прошлом в качестве косметических средств использовали лишь природные вещества. Например, веки подкрашивали в голубой цвет тончайшей пыльцой из толченой бирюзы, а брови красили сурьмяным блеском. С развитием химии, помимо природных веществ, стали использовать и синтетические. Что же собой представляют современные косметические средства? Слушаем сообщения на тему: 1) Губная помада. 2) Духи. 3) Пудра 4) Крем и лосьон. 5) Средства для бритья.
Упражнения по составлению формул веществ.
1. В состав губных помад входят сложные эфиры, например бутилстеарат, мирициловый эфир пальмитиновой кислоты. Составьте уравнения реакций их получения, зная, что мирициловый спирт имеет состав С30Н61ОН.
2.Запах гиацинта духам придает фенилэтаналь( ближайший гомолог бензальдегида). Составьте его формулу.
3. В составе пудры в качестве вспомогательных компонентов присутствуют стеарат магния и стеарат алюминия. Составьте их формулы. Какие вещества можно взять для их получения?
4.В состав лака для ногтей входит смесь растворителей, чаще всего этилацетат, бутилацетат, изопропиловый спирт. Составьте формулы этих веществ. К какому классу веществ они относятся? Дайте им другие названия.
5.В составе многих средств для умывания имеется 2- бром- 2- нитропропандиол-1,3. Составьте его формулу.
Путешествие по ванной комнате.
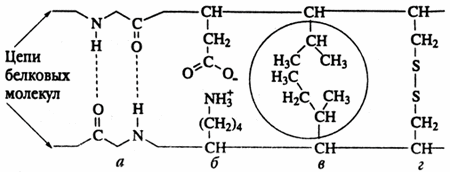
Рисунок 1
а – водородные связи, б – ионные связи, в – взаимодействие между неполярными радикалами, создающие области, из которых вытесняется вода, г – дисульфидная связь между двумя остатками цистеина.
С химической точки зрения – это кератин. Кератин представляет собой фибриллярный белок. В молекуле кератина присутствует несколько типов связи атомов.
Почему влажные волосы способны растягиваться на 30-50%? Под действием воды водородные и ионные связи в белковых цепях, из которых состоят волосы, разрываются, и это вызывает изменение формы белка, а как следствие растяжение волоса. После высыхания разорванные связи восстанавливаются, и волосы приобретают прежнюю длину.
Ежедневно ваши волосы утрачивают кератин. Шампунь Палмолив оптима содержит протеины кератина, позволяющие восстановить волосы» - именно так звучит текст телерекламы. Что в этом утверждении бесспорно с позиции химика, а что вызывает сомнение? Выясним, как волосы могут утрачивать кератин? Химические изменения, протекающие при мытье волос, обратимы: после высыхания нарушенные связи восстанавливаются. Так что утрачивать кератин волосы могут только за счет механического процесса отламывания посеченных участков волоса. Но со здоровыми волосами это не возможно. В тоже время шампунь с протеинами кератина, безусловно, полезная вещь. Протеины – простые белки, состоящие только из остатков аминокислот, они могут в процессе мытья присоединяться к молекулам кератина волос за счет слабых связей, например водородных, и таким образом хотя и на время, но укреплять верхний слой волос.
Все средства должны иметь нейтральный рН
В шампуни в качестве образователей и стабилизаторов пены добавляют додецилбензол. Составьте формулу этого вещества, зная, что додекан-это алкан, содержащий в цепи 12 атомов углерода. Чтобы шампунь был прозрачным при любой погоде в него добавляют пропиленгликоль. Что это за вещество? К какому классу принадлежит?
Моющие и чистящие средства.
Мыло – первое гигиеническое средство, с которым встречается каждый человек после рождения. Мылом как моющим средством человечество пользуется давно. Например, на Руси мыловарение было налажено уже в YIII веке, а в ряде европейских государств – и того раньше.
Известно, что мыло обладает поверхностной активностью, – оно снижает поверхностное натяжение воды. Однако обычные мыла обладают и существенными недостатками. У них плохая моющая способность в воде, а в водных растворах они гидролизируются с образованием щелочи. Эта щелочь оказывает вредное действие на многие ткани (шерсть, шелк и др.)
Задание: Вам пришлось стирать темные вещи с мылом в жесткой воде. После стирки и полоскания на них остался «седой налет». Как его устранить и, что можно было сделать, чтобы это предотвратить? Написать молекулярные и ионные уравнения протекающих процессов.
Ответ: Мыло в жесткой воде плохо мылится и образует осадок стеарата кальция:
2 С17 Н35 СОО Na + Ca (HCO3)2 = (C17 H35 COO)2 Ca + 2Na HCO3
Этот осадок проступает на темных тканях в виде седого налета.
Избавиться от него можно, если прополоскать вещи в слабом растворе уксусной кислоты.
(C17 H35 COO)2 Ca + 2 СН3 СООН = 2 C17 H35 СООН + Ca (CH3 СОО)2
Чтобы этого не произошло, следовало предварительно смягчить воду кипячением или добавлением соды.
В настоящее время широко используют синтетические моющие средства (СМС).
В чем преимущества синтетических моющих средств? Какие добавки используют в них? Слушаем сообщение.
Отвечаем на вопрос практического характера. Почему стиральные порошки с биологическими добавками особенно сильно разъедают кожу рук?
Ответ: В эти типы порошков добавляют ферменты, разрушающие белковые загрязнения. Эти добавки будут частично разрушать и молекулы керотина, из которого состоит верхний слой кожи.
Химия и пища.
Искусственная пища. Что мы о ней знаем? Пищевые добавки. Задумайтесь, нужны ли вам продукты, содержащие эти вещества? Может заменить их более полезными?
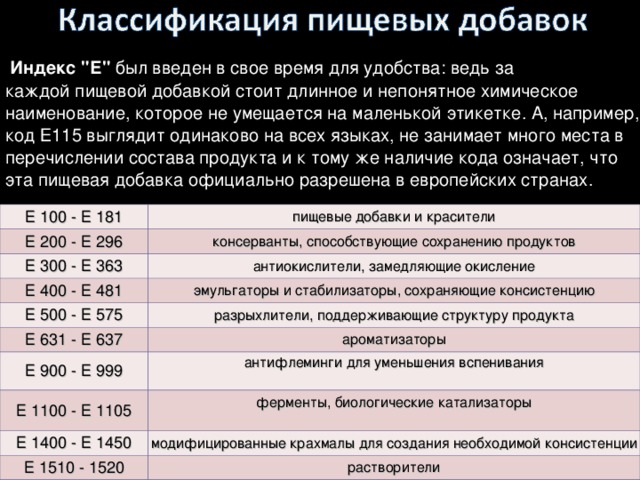
Пищевые добавки. Заполняем таблицу и смотрим их значение.
| Код пищевой добавки (Е) | Физиологическое действие |
| 103, 105, 111, 121 (краситель цитрусовый, красный 2), 123(красный амарант), 125, 126, 130,152,240(консервант формальдегид) | Запрещенные добавки |
| 102, 110, 120, 124, 127 | Опасные добавки |
| 103,105, 121, 123, 125, 126, 130, 131, 142, 152,210,211(бензоат натрия), 213 -217, 240, 330(лимонная кислота), 447 | Вызывают злокачественные опухоли |
| 221 -226, 320 -322, 338 -341, 407, 450,461 -466 | Вызывают заболевания желудочно – кишечного тракта |
| 230, 231, 232, 139, 311 -331 | Вызывают аллергию |
| 171 -173, 320 -322 | Вызывают болезни печени и почек |
| 230, 231, 232 | Вещества, вредные для кожи |
| 338 -341, 407, 450, 461 -466 | Вызывают расстройство желудка, а в больших дозах – пищевые отравления |
| 320, 321 | Повышают содержание холестерина |
Вещества любви.
В заключении я бы хотела сказать о чувстве, которое знакомо всем и есть в любой квартире - это любовь. Несмотря на весь романтический лоск, любовь, сложный химический процесс, подчиняющийся законам природы. Вот что говорил на эту тему академик В.А. Таболин: Если расшифровать формулу любви, то на практике она означает, что в зависимости от выделения определенных веществ возникает непреодолимая тяга одного человека к другому конкретному человеку. Любовь – выдающиеся событие в психической жизни человека, поэтому не стоит удивляться тому, что в истоках ее лежат биохимические процессы, происходящие в сложном человеческом организме.
Если говорить на научном языке, то любовь можно разделить на три стадии: влюбленность, зрелое чувство, остывание. Первая стадия схожа со стрессом, которая сопровождается выделением амфетаминов: адреналина и других. Эти вещества стимулируют нервную систему и активизируют жизненные процессы. Но пребывание в состоянии влюбленности долгое время вредно для организма. Эти амфетамины (ароматические азотсодержащие вещества) вступают в реакции с кислородом, водой и другими веществами и выделяют в организм токсичные вещества. И чем выше концентрация амфетаминов, тем больше токсинов выделяется. В результате влюбленный худеет, бледнеет, плохо спит, теряет аппетит. Но зато влюбленные не болеют гриппом. Это для организма изнурительно. Чтобы организм выжил, природа включает механизмы, тормозящие выработку амфетаминов, меняя их на другие соединения – эндоморфины. Наступает вторая стадия – зрелое чувство. Это переход к стабильным отношениям, сопровождающимся ощущением радости, счастья. Эндоморфины – это гормоны радости. Это вещества белковой природы, они не чужеродны для организма. Если концентрация эндоморфинов в крови постепенно снижается, то наступает переход в стадию угасания отношений. Скорость этого процесса у разных организмов разная.
4. Заключительное слово, подведение итогов урока.
Итак, человек встречается с химией на каждом шагу. Наша жизнь, здоровье, настроение тесно связаны с бесчисленными химическими веществами и процессами вокруг нас и внутри нас самих. Надеюсь, что сведения, полученные на этом уроке, окажутся вам полезными. Химия дает в руки человеку огромные возможности и силы, но при этом требует грамотного, ответственного их использования, понимания сущности химических явлений.
Домашнее задание п. 27, упражнение 1,2 стр. 348.
Источники информации:
Химия.11 класс: учеб. для общеобразоват. учреждений /О.С.Габриелян. – 15-е изд., стереотип. - М.: Дрофа, 2013.
Настольная книга учителя. Химия,11 класс / О.С.Габриелян, И.Г. Остроумов. – М.: Дрофа, 2012.
Современные технологии в процессе преподавания химии: Развивающее обучение, проблемное обучение, кооперация в обучении, компьютерные технологии/ Авт.-сост. С.В. Дендебер, О.В. Ключникова, - М.: 5 за знания, 2011
Химия. 11 кл.: рабочая тетрадь к учебнику О.С. Габриеляна – 5-е изд., стереотип. - М.: Дрофа, 2011