Урок с ИКТ по теме «Соли».
Химия 8 класс.
Учебник: Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2012г.
Урок с использованием ИКТ.
Учитель: Смольнякова О.В.
Цель урока: Выяснить почему соли являются производными кислот и оснований?
Задачи урока: Обучающие.Дать определение солей.
2. Рассмотреть состав и название солей.
3. Продолжить обучение школьников определять степени окисления в сложных соединениях.
4. Научить, составлять формулы солей.
5. Познакомить с физическими свойствами солей.
6. Познакомить учащихся с классификацией солей.
Развивающие: развивать составление степени окисления элементов, мышление, память, внимание, логическое мышление, умение работать в парах, умение работать с малым набором реактивов.
Воспитывающие: воспитание толерантности, ценностного самосознания, умение работать в парах, индивидуально, в коллективе.
Методы: частично- поисковый, объяснительно- иллюстративный.
Форма организации деятельности: коллективная, парная, индивидуальная.
Межпредметные связи: биология, география.
Оборудование: Таблица Д.И.Менделеева, ПК, экран, штатив с пробирками.
Реактивы: Образцы солей: медный купорос, железный купорос, мел, хлорид натрия, сульфат магния.
|
| Организационный момент. Постановка цели и задач урока |
|
Слай-ды 2 – 11
Слай-ды 12-13
|
Проверка изученного материала.
Домашнее задание С классом проводится фронтальный опрос: Вопросы (Слайд2): Какие классы веществ вы знаете? Что такое оксиды? Что такое основания? Что такое кислоты? Что такое основные оксиды, (кислотные оксиды, амфотерные)? К какому классу относятся вещества, дать им названия. (Слайды3,4) NO, HNO3, NaOH, HNO2, CO2, Mg(OH)2, H2CO3, H2SO3, H2SO4.
Тест учащиеся выполняют письменно по вариантам (Сдайд5): Определите ряд формул, состоящих только из кислотных(1 вариант); основных оксидов – 2 вариант а) Na2O, N2O, CuO; б) CO2, P2O5, Cl2O7; в) MgO, BaO, ZnO; г) Li2O, CaO, CO. Слайд (6) Слайд 6. Выберите из списка веществ формулы только кислот (1 вариант) только оснований (2 вариант): а) НСI, а) AICI3, CO2, H2SO4 б) H2S б) Н2SO4, HCI, HNO3, HF в) Na в)Na OH, BaCI2, CO, Ca(OH)2 г) г) AI(OH)3, NaOH, KOH, Ba(OH)2 Слайд 7. Выберите формулу оксида серы (IV) – 1 вариант, оксида углерода (II) – 2 вариант: а)H2S б) CO в) HNO3 г) ZnO д) SO2 Слайд 8. Выберите формулу серной кислоты – 1 вариант, сернистой – 2 вариант: а) H2SiO3 б) H2SO4 в) H2 SO3 г) H2 S Слайд 9. . Выберите формулу гидроксида калия – 1 вариант, гидроксида кальция – 2 вариант: а) Ba(OH)2, б) NaOH в) KOH г) Ca(OH)2 Слайд 10 Выберите формулы растворимого в воде основания – 1 вариант, нерастворимого в воде основания: а)Cu(OH)2 б) KOH в) LiOH г) AI(OH)3 Слайд 11. Выберите формулы, в которых лакмус изменяет цвет на красный – 1 вариант, на синий – 2 вариант: а) НСI б) H2SO4 в) NaOH г) KOH
Учащиеся меняются попарно листочками и проверяют выполнение теста. На экране изображены правильные ответы и критерии оценивания учащихся. Выставляют друг другу оценки.
|
|
Слай-ды 14 - 15
Слайд 16
Слайд 17
Слай-ды 18-22
Слайд 23
Слай-ды 24 – 25
Слай-ды 26-27
Слайд 28
| Объяснение нового материала.
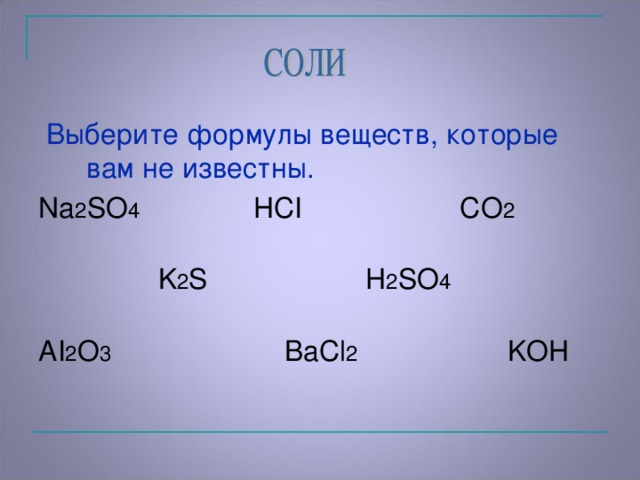
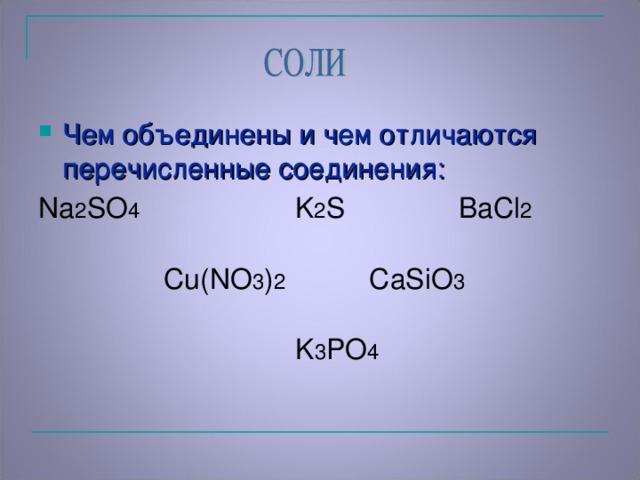
Учитель просит из предложенных формул выбрать те формулы, которые они ещё не изучали. И сравнить, чем они сходны между собой, а чем отличаются? (предполагаемый ответ: сходство - во всех формулах на первом месте присутствует металл, а отличаются кислотными остатками).
Учитель просит учащихся сформулировать определения самим, а затем поверяют по изображению на экране.
| Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков. |
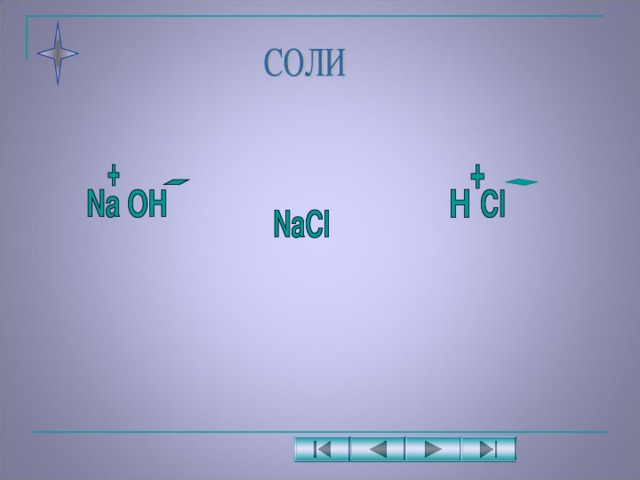
Образование соли хлорида натрия и выяснение у учащихся, почему соли считаются производными кислот и оснований? (ответ: они образуются из кислот и оснований)
Учитель просит обратить внимание учащихся на некоторых представителей солей: поваренная соль (обращает внимание на пословицы на доске) , гипс, железный купорос, медный купорос, карбонат кальция, сульфат магния. Учащиеся рассказывают (2 учащихся) кратко о поваренной соли и карбонате кальция.
Учитель. Сегодня мы с вами посещаем Страну веществ, классовое название которых означает «рождённые солнцем». Почему же «рождённые солнцем»? Да потому что многие вещества этого класса любят «прятаться» в воде. Но как только горячие солнечные лучи выпарят воду, эти вещества предстают перед нами во всей своей красе. Посмотрите, какими разными они бывают!
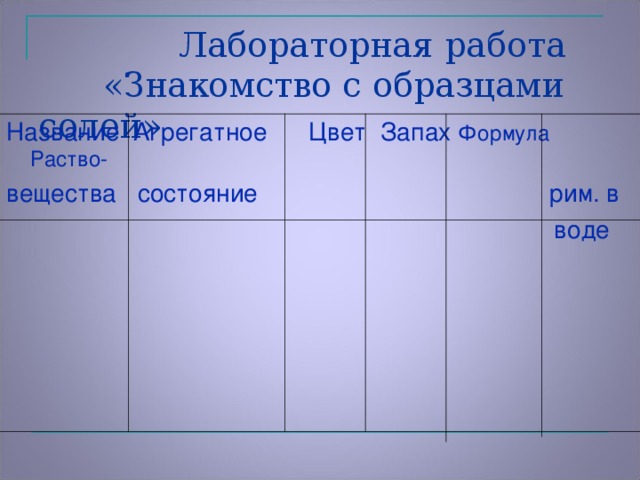
Учащиеся, работая в парах, знакомятся с образцами солей и проводят лабораторную работу, заполняя таблицу. | Название вещества | Агрегатное состояние | Цвет | Запах | Формула | Раство- римость в воде | | Карбонат кальция |
|
|
| CaCO3 |
| | Кристаллогидрат сульфата меди (II) – медный купорос |
|
|
| CuSO4*5H2O |
| | Хлорид натрия |
|
|
| NaCI |
| | Кристаллогидрат сульфата железа (II) – железный купорос |
|
|
| FeSO4*7H2O |
| | Сульфат магния |
|
|
| MgSO4 |
|
Учащиеся после выполненной работы делают выводы. Соли представляют из себя твёрдые вещества, кристаллические, хорошо растворимые в воде, с разнообразным цветом.
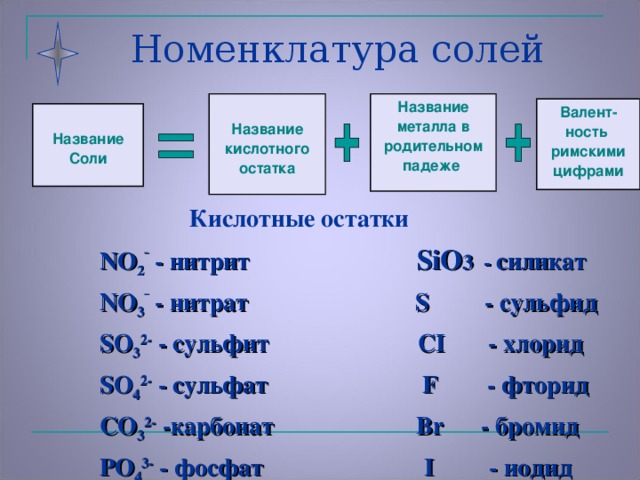
Номенклатура солей
|
Название соли |
= | Название кислотного остатка |
+ | Название металла в родительном падеже |
+ |
С.О. или вал. металла | Формулы кислотных остатков и их названия. Задание 1:По таблице растворимости дать названия всех солей для иона натрия.
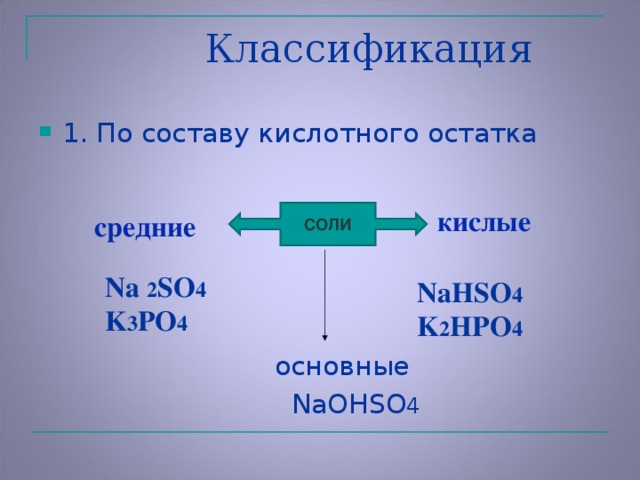
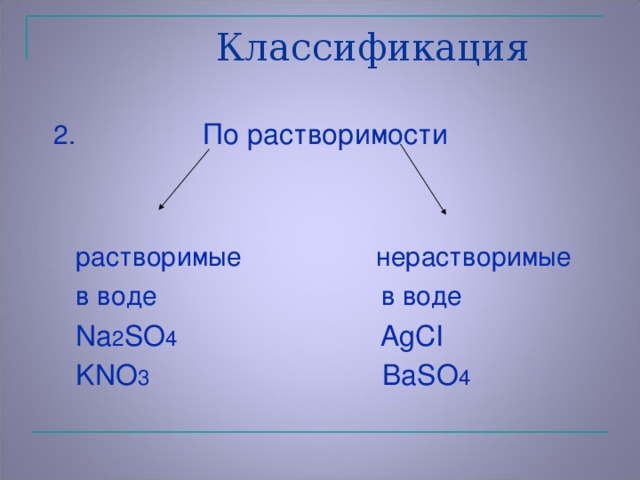
Задание 2: С помощью таблицы растворимости составить формулу сульфата алюминия (Слайд 25): При составлении формулы соли необходимо: расставить заряды ионов металлов и заряды ионов кислотных остатков; по правилу креста расставить коэффициенты. Чётные коэффициенты сократить. IV. Закрепление. Составьте формулы: сульфата натрия, сульфата кальция, сульфата железа(III). Классификация солей По составу: средние, кислые, основные (определения учащиеся формулируют сами) По растворимости: растворимые в воде и нерастворимые
Закрепление: Задание 3: Определить степени окисления каждого элемента для солей: Na2CO3, MgSO4, K3PO4 и дайте названия солям. Определение степеней окисления каждого элемента аналогично кислотам: Na+12CХ O3-2 +1 + Х + (-2)∙3 = 0 Х = + 4
Na+12C+4 O3-2. Фронтальный опрос класса: По цели урока и задачам урока Что такое соли? Дать названия веществам: Ca(NO3)2, K2SO3, Li2CO3, CuSO4. Определить растворимость этих веществ № 1 после & 21 Составить формулы солей: нитрита магния, силиката натрия, фосфата кальция. Учащиеся зачитывает стихотворение о солях. |
|
Слайд 29 |
V. Домашнее задание: § , 21 Упр.2, 3, наизусть названия солей: на примере металла натрия (учитель даёт памятку для каждого учащегося) Соли NaCI - хлорид натрия Na2SO4 - сульфат натрия Na2SO3 - сульфит натрия Na2S - сульфид натрия Na2CO3 - карбонат натрия Na3PO4 - фосфат натрия NaNO3 - нитрат натрия NaNO2 - нитрит натрия NaF - фторид натрия NaBr - бромид натрия NaI - иодид натрия Na2SiO3 - силикат натрия
|
|
|
VI. Итоги урока. Оценки. |
Приложение: Слайды.
Список литературы.
1. О.С.Габриелян Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2012г.
3. Ресурсы Интернета.
В ходе занятия учащиеся смогут:
- актуализировать знания по классам неорганических соединений;
- расширить представление о солях, рассмотрев состав и названия солей;
- самостоятельно приобрести и поделиться информацией о важнейших представителях неорганических солей;
- продолжить обучение определения с.о. элементов и зарядов ионов в сложных веществах (солях);
- начать знакомство с генетическими рядами металла и неметалла (без реакций);
- продолжить формирование навыков анализа понятийного аппарата, работы с СD – ресурсами (проводить поиск, обработку и систематизацию информации), участия в дискуссии, делать обобщающие выводы, практических умений и навыков;
- развивать умение понимать и принимать чужую позицию при работе в группе (воспитание толерантности, ценностного самосознания).
Поваренная соль
Хлорид натрия – это единственное минеральное сырьё, которое человек употребляет в пищу в чистом виде. Без соли не возможны физиологические процессы в организме. Она в виде ионов содержится в крови, обеспечивает работу эритроцитов, в мышцах обуславливает способность в возбудимости. В тех странах, где соли было мало, люди прибегали к различным способам удовлетворить свои потребности в ней. Меланезийцы каждое утро натощак пили морскую воду. В Новой Зеландии пищу запевали морской водой. На островах Самоа, Таите и Тонга население употребляло в пищу сырую рыбу, обмакивая её в морскую воду, налитую в скорлупу кокосовых орехов. В Северной Америке индейские племена высушивали и прессовали специальной вид морской водоросли и этим своеобразным пирогом закусывали каждый кусок пищи. У травоядных животных потребность в поваренной соли высока. Лошади, коровы, козы, овцы с удовольствием едят солёный корм. Дикие животные пьют воду солёных источников и едят солончаковые травы. Все пищевые продукты содержат поваренную соль в некотором количестве: мука – 0,01%, картофель – 0,04%, фрукты – 0,05 %, молоко – 0,15%. Прибавляя к пище ежедневно около 20 г соли, человек съедает в год 7 – кг, а за 70 лет – 500 кг.
Карбонат кальция.
Известняк. Это минерал органического происхождения. Он используется в строительстве, из него производят много строительных материалов. Он идёт на производство цемента, карбида кальция, соды, извести.
Мел. Из него изготавливают зубной порошок и школьные мелки. Это ценная добавка при производстве бумаги, резины, в строительстве – при побелки зданий.
Мрамор. Это плотная кристаллическая порода. Естественный цвет его белый, но различные примеси окрашивают его в различные цвета. Чистый мрамор встречается редко, его используют на работу скульптуры. Цветной мрамор используется как облицовочный материал в строительстве зданий.
Карбонат кальция. Входит в состав наружного скелета моллюсков (раковин), скорлупы яиц.
Фосфат кальция. Входит в состав внутреннего скелета позвоночных: костей, зубов. Он входит в состав апатитов и фосфоритов. Минерологи назвали так этот минерал, что в переводе апатит с греческого означает «обманщик». Он может менять свой внешний вид, то быть похожим на кварц, известняк или мрамор.
Лабораторная работа
«Знакомство с образцами солей».
| Название вещества | Агрегатное состояние | Цвет | Запах | Формула | Растворимость в воде |
| Карбонат кальция |
|
|
| CaCO3 |
|
| Кристаллогидрат сульфата меди (II) – медный купорос |
|
|
| CuSO4*5H2O |
|
| Хлорид натрия |
|
|
| NaCI |
|
| Кристаллогидрат сульфата железа (II) – железный купорос |
|
|
| FeSO4*7H2O |
|
| Сульфат магния |
|
|
| MgSO4 |
|
Тест
По теме: «Оксиды, кислоты, основания».
1 вариант.
1.Выберите букву с формулами веществ, в которой находятся формулы только кислотных оксидов:
а) Na2O, N2O, CuO;
б) CO2, P2O5, Cl2O7;
в) MgO, BaO, K2O;
г) Li2O, CaO, CO.
2. Выберите из списка веществ формулы только кислот:
а) НСI, AICI3, CO2, H2SO4
б) H2SO4, HCI, HNO3, HF
в) NaOH, BaCI2, CO, Ca(OH)2
г) AI(OH)3, NaOH, KOH, Ba(OH)2
3. Выберите формулу оксида серы (IV):
а)H2S б) CO в) HNO3 г) ZnO д) SO2
4. Выберите формулу серной кислоты:
а) H2SiO3 б) H2SO4 в) H2 SO3 г) H2 S
5. Выберите формулу гидроксида калия:
а) Ba(OH)2, б) NaOH в) KOH г) Ca(OH)2
6. Выберите формулы растворимого в воде основания:
а)Cu(OH)2 б) KOH в) LiOH г) AI(OH)3
7.Выберите формулы, в которых лакмус изменяет цвет на красный:
а) НСI б) H2SO4 в) NaOH г) KOH
Тест
По теме: «Оксиды, кислоты, основания».
2 вариант.
1.Выберите букву с формулами веществ, в которой находятся формулы только основных оксидов:
а) Na2O, N2O, CuO;
б) CO2, P2O5, Cl2O7;
в) MgO, BaO, K2O;
г) Li2O, CaO, CO.
2. Выберите из списка веществ формулы только оснований:
а) НСI, AICI3, CO2, H2SO4
б) H2SO4, HCI, HNO3, HF
в) NaOH, BaCI2, CO, Ca(OH)2
г) AI(OH)3, NaOH, KOH, Ba(OH)2
3. Выберите формулу оксида углерода (II):
а)H2S б) CO в) HNO3 г) ZnO д) SO2
4. Выберите формулу сернистой кислоты:
а) H2SiO3 б) H2SO4 в) H2 SO3 г) H2 S
5. Выберите формулу гидроксида кальция:
а) Ba(OH)2, б) NaOH в) KOH г) Ca(OH)2
6. Выберите формулы нерастворимого в воде основания:
а)Cu(OH)2 б) KOH в) LiOH г) AI(OH)3
7.Выберите формулы, в которых лакмус изменяет цвет на синий:
а) НСI б) H2SO4 в) NaOH г) KOH