Классификация химических реакций
(урок-практикум с применением ИКТ)
Автор: Горячкина Ирина Анатольевна
учитель химии высшей категории
ГБОУ СОШ №2 «ОЦ» с. Кинель – Черкассы,
Самарской области
2015г
Цели урока:
обобщить представления о классификации химических реакций;
закрепить умения учащихся записывать уравнения химических реакций в неорганической химии и характеризовать их;
продолжить формирование практических умений проводить эксперимент, соблюдая правила техники безопасности, и анализировать наблюдения;
способствовать развитию интеллектуальных ресурсов личности и умению общаться в группе, коллективе.
Планируемые результаты урока:
учащиеся должны уметь называть типы химических реакций;
определять тип химической реакции по уравнению;
составлять уравнения химических реакций различного типа;
проводить наблюдения за признаками реакций, анализировать и делать выводы,
соблюдать правила техники безопасности при выполнении демонстрационных опытов.
Тип урока: урок - практикум
Формы работы: фронтальная, индивидуальная, групповая
Оборудование и реактивы:
2) мультимедиапроектор;
2) мультимедийная презентация;
3) рабочий лист учащегося;
4) реактивы - металлы (магний, железо, медь), серная кислота (разбавленная и концентрированная), соляная кислота (разбавленная), оксид меди (порошок), карбонат кальция, пробиркодержатель, спиртовка.
Ход урока
I. Организационный момент.
Вопрос: Как вы думаете – о чем у нас сегодня на уроке пойдет речь?
СЛАЙД 1- ТЕМА УРОКА
СЛАЙД 2 - ЦЕЛЬ УРОКА
СЛАЙД 3 – МАРШРУТ УРОКА
Вопрос: Какие типы химических реакций вам известны?
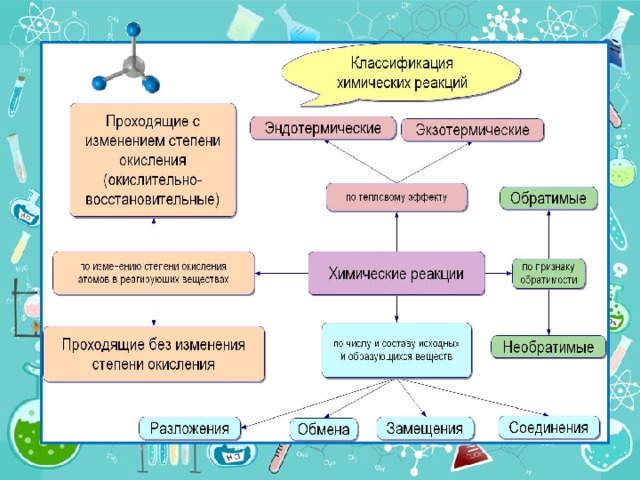
СЛАЙД 4- КЛАССИФИКАЦИЯ РЕАКЦИЙ
II. Этапы урока.
I. Теоретическая часть
Задание 1.
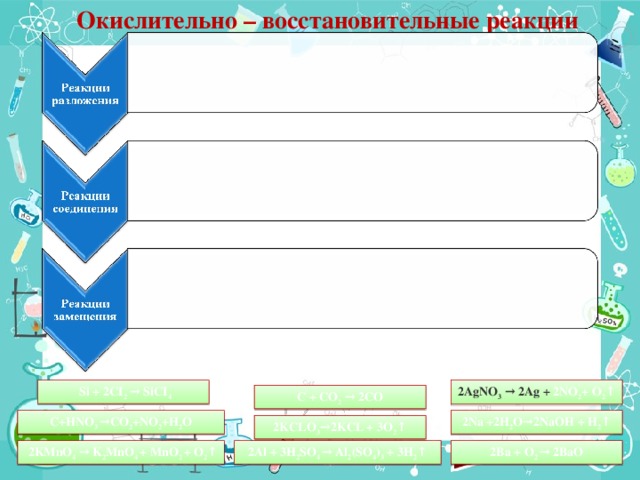
А) Используя материал §11 (стр. 43 – СХЕМА 3), распределите предложенные окислительно – восстановительные реакции согласно их типу:
2AgNO3 → 2Ag + 2NO2+ O2↑
Si + 2CI2 → SiCI4
2Na +2H2O→2NaOH + H2↑
2Ва + O2 → 2BaO
C+4HNO3 →CO2+4NO2+2H2O
2KCLO3→2KCL + 3O2↑
C + CO2 → 2CO
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2KMnO4 → K2MnO4 + MnO2 + O2↑.
Б) В каком уравнении реакции отсутствуют коэффициенты? Найдите его и расставьте коэффициенты методом электронного баланса.
В) Почему реакции ионного обмена нельзя отнести к реакциям ОВР?
(не происходит изменения степеней окисления элементов)
Задание 2.
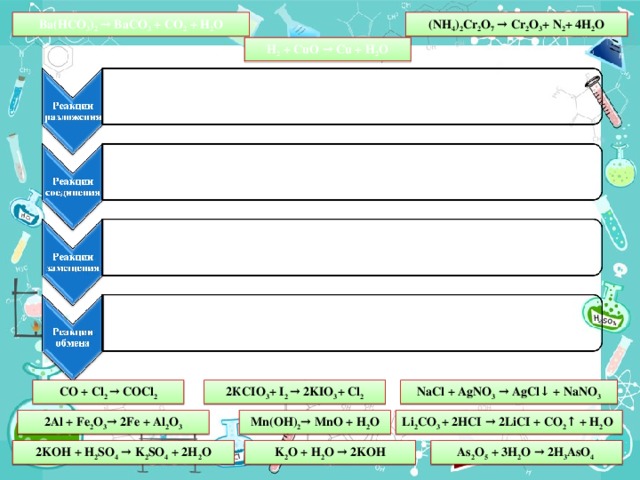
А) Используя материал §11 (стр. 45 – СХЕМА 4), распределите предложенные реакции согласно их типу:
Ba(HCO3)2 → BaCO3 + CO2 + H2O
H2 + CuO → Сu + H2O
Li2CO3 + 2HCI → 2LiCI + CO2↑ + H2O
As2O5 + 3H2O → 2H3AsO4
(NH4)2Cr2O7 → Cr2O3+ N2+ 4H2O.
2Аl + Fe2O3→ 2Fе + Аl2О3
CO + Cl2 ↔ COCl2
2KOH + H2SO4 → K2SO4 + 2H2O
Mn(OH)2→ MnO + H2O
NaCl + AgNO3 → AgCl↓ + NaNO3
K2O + H2O → 2KOH
2КСIO3+ I2 → 2KIO3+ Сl2
Вопрос: По каким признакам можно судить о прохождении именно химической реакции?
Выделение теплоты, выпадение осадка, появление запаха и т.д. (показываю на слайде, после ответа уч-ся)
Б) Выберите из предложенных реакций обмена реакцию нейтрализации и запишите полное и краткое ионное уравнение данной реакции.
Задание 3.
Для классификации реакций по тепловому эффекту и признаку обратимости воспользуйтесь реакциями из задания 2.
А) Выберите из предложенных реакций одну экзотермическую и одну эндотермическую, запишите их в «Рабочий лист учащегося» (реакции соединения или обмена; реакции разложения или замещения)
Б) Выберите из предложенных реакций одну обратимую реакцию и одну необратимую, запишите их в «Рабочий лист учащегося» (Ba(HCO3)2 → BaCO3 + CO2 + H2O. т.к. угольная кислота, как только образуется, сразу разлагается, поэтому реакция может идти обратимо);
Необратимая – это реакции ионного обмена (осадок, газ, вода)).
Вопрос: Какие условия необходимы для протекания химической реакции? (температура, измельчение веществ и т.д.- на слайде).
II. Химический практикум
Задание: Проведите химические реакции, доказывающие влияние условий на их протекание. Запишите свои наблюдения в таблицу.
Реактивы – металлы - магний, железо, медь, цинк; серная кислота (разбавленная (1:10) и концентрированная (1:5)), оксид меди (порошок), карбонат кальция, соляная кислота (разбавленная), пробиркодержатель, спиртовка.
| Исходные вещества | Условия реакций | Признаки реакций | Уравнения реакций | Тип реакции |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Видеоролик – влияние катализатора и ингибитора на протекание химической реакции.
III. Коррекция знаний (обобщение результатов работы в группах) и первичная проверка знаний (тест).
А) Проверьте «Рабочий лист учащегося».
Б) Выполните тест на закрепление темы.
| I вариант 1) Реакция, уравнение которой 2KOH + H2SO4 → K2SO4 + 2H2O, является: А. Эндотермической, обмена; В. Обмена, экзотермической; Б. Обмена, каталитической; Г. Гетерогенной, обмена. 2) Укажите обратимую реакцию: А. 2Al + 3O2 → Al2O3 Б. 2Na + 2H2O → 2NaOH + H2 В. N2 + 3H2 → 2NH3 Г. C3H8 + 5O2 → 3CO2 + 4H2O 3) Верно утверждение, что реакция нейтрализации – это реакция: А) окислительно-восстановительная; Б) обмена; В) всегда обратимая; Г) каталитическая. 4) С наименьшей скоростью при комнатной температуре протекает реакция между: А. Fe и H2SO4(р-р); Б. AgNO3(р-р) и NaCl(р-р); В. Cu и O2; Г. C2H5OH и Na.
| II вариант 1) Экзотермической является реакция: А) МgCO3 → MgO + CO2; Б) 2 H2O2 → O2 + 2Н2О В) S+O2 → SO2; Г)2 H2O → O2 + 2Н2 2) К окислительно-восстановительным относится реакция, уравнение которой: А. Al2O3+ 6HCl →2AlCl3+ 3H2O; Б. CaO + H2O → Ca(OH)2; В. H2O + SO2 ↔ H2SO3; Г. Zn+ Cu(NO3)2 → Zn(NO3)2 + Cu 3) Скорость химической реакции зависит от: А. природы реагирующих веществ; Б. температуры реакции; В. присутствия катализатора; Г. от каждого из перечисленных факторов 4) Необратимой является реакция: А) разложения угольной кислоты; Б) получения сернистой кислоты из оксида серы(IV) и воды; В) разложения гидроксида меди (П); Г) получения аммиака из простых веществ. |
| Взаимопроверка: обменяйтесь тестами с соседом по парте |
Итак, подведем итог урока: что мы сегодня повторили на уроке? (ВЕРНУТЬСЯ НА СЛАЙД № 4 – КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ)
Добились ли мы поставленной цели?
III. Рефлексия
Сделай вывод:
| Что было трудно запомнить на уроке | Что нового узнал на уроке | Что вызвало интерес на уроке |
|
| | |
Подумай, кого из одноклассников ты бы отметил за работу на уроке?