Цель урока: изучить общие свойства кислот
Задачи: 1.образовательные- изучить общие свойства кислот;
2.развивающие- способствовать развитию умений учащихся проводить экспери-
мент для получения новых знаний; развитию речевых навыков учащихся, умению
сравнивать, обобщать и делать выводы;
3.воспитательные-воспитывать в детях чувство товарищества, умение работать в
коллективе, воспитывать интерес к предмету, соблюдать ТБ.
Оборудование: спиртовка, спички, пробирки, держатель
Реактивы: HCl, H2SO4, NaOH, CuSO4, CuO, Zn,Cu
Ход урока
I.Организационный момент
II.Проверка знаний
Проверяем выполнение упражнений № 2,3,4
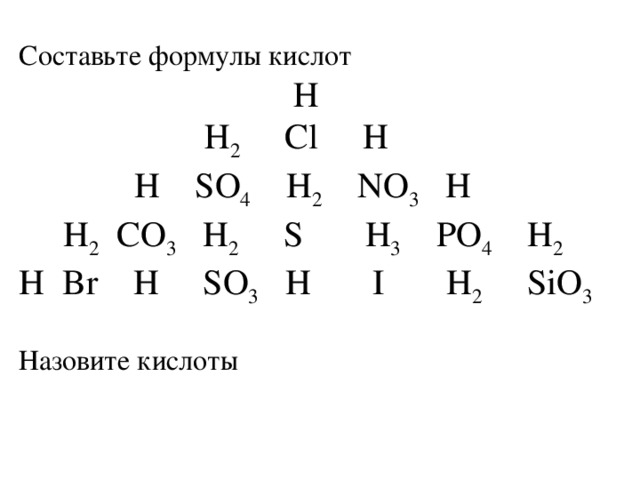
Слайд 1. Составить формулы кислот и назвать их.
Наибольшее значение имеют серная, азотная и соляная кислоты. Слайд 2.
Слайд 3. «Третий лишний»
Задание: в каждом ряду вычеркни лишнюю формулу (объясните свой выбор)
- H3PO4 H2S HF
- H2SO4 H2SiO3 H3PO4
3. HCl HBr H2S
Это задание позволит учащимся вспомнить классификацию кислот.
Слайд 4. Знаете ли вы, что….
Сицилийское озеро является самым опасным в мире. В его водах содержится большая концентрация серной кислоты, которая поступает в озеро из подземных источников. Естественно, в озере не водится никакой рыбы и подходить к нему близко смертельно опасно как для животных, так и для человека. Местные жители прозвали этот водоем озером смерти. Однако именно такой состав озера делает его потрясающе красивым.
Слайд 5. Проверочная работа
Дать характеристику, используя различные признаки классификации.
1 вар. 2 вар.
H2SO4 HCl
Запишите способ получения этих кислот.
Обсудить результат работы, выборочно взять тетради на проверку.
III. Изучение нового материала.
Какими бы разными не были кислоты, они обладают общими свойствами.
Сегодня на уроке мы будем изучать химические свойства кислот.
Запишите тему урока в тетрадь. Слайд 6.
Я предлагаю каждой группе провести опыт, пользуясь карточкой-инструкцией и предоставить отчет о его проведении. Время работы 5-7 мин. Затем результаты оформим в тетрадь.
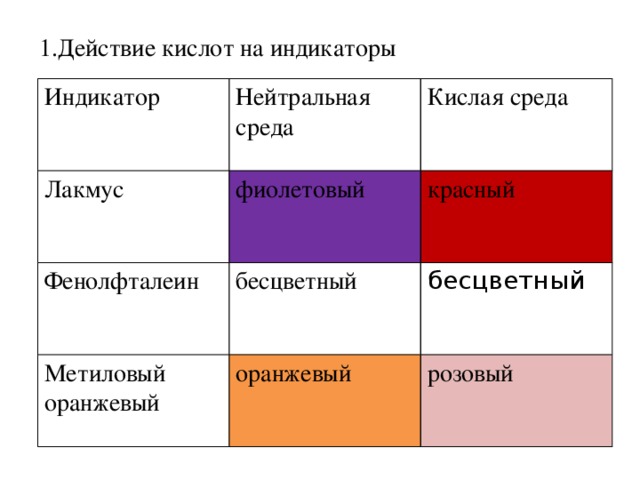
Ребята, вы работали с кислотами. Как мы узнаем, что именно кислота находится в пробирке? Может ее надо попробовать? - нет, надо использовать индикаторы.
Правильно, индикаторы- это указатели. Посмотрим видео.
Что указывает индикатор? – кислотность среды.
Какие вещества мы уже определяли с помощью индикатора? – щелочи.
Слайд 7.
Теперь давайте проанализируем опыты, которые вы провели, сделаем выводы и запишем в тетрадь.
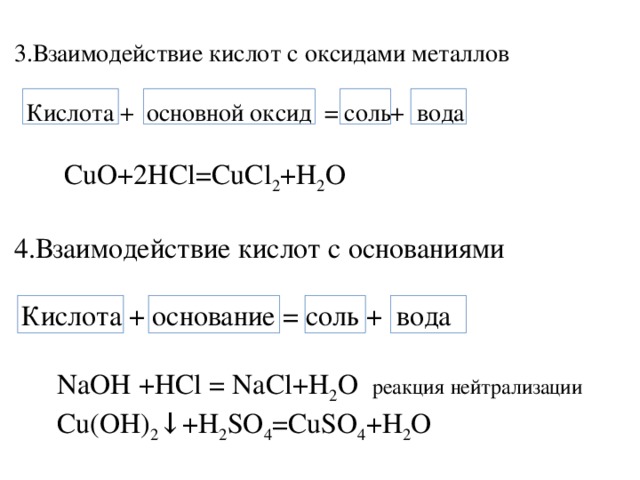
Каждая группа комментирует результаты своей работы. Я показываю слайды, соответствующие этим опытам. Слайд 8-10. Ребята записывают в тетрадь уравнения реакций.
IV. Закрепление
Слайд 11.
Задание :
С какими из перечисленных веществ будет реагировать хлороводородная кислота: SiO2, KOH,H3PO4, Ag, Fe(OH)3, CaO, Mg, Na2SO3
Сначала мы с ребятами анализируем, с какими веществами кислота может реагировать, они называют возможные варианты, а затем мы приходим к общему выводу и составляем уравнения реакций. Все записываем на доске, чтобы ребята могли проверить себя и своих товарищей, если надо комментируем и исправляем ошибки.
V.Домашнее задание
Слайд 12.
§ 32 упр.7,8 стр. 104
Осуществить превращения:
H2O→O2 →P2O5→H3PO4→Ba3 (PO4)2
Подготовить сообщения о применении 5 кислот