Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Конспект урока по химии"Получение и свойства кислот"
Урок химии в 8-м классе по теме: "Кислоты. Химические свойства кислот в свете теории электролитической диссоциации."
Цели урока:
• Образовательная: Познакомить учащихся с одним из важнейших классов неорганических соединений, изучить классификацию и номенклатуру кислот.
• Развивающая: Совершенствовать практические умения и навыки работы с лабораторным оборудованием и химическими реактивами; дополнить знания учащихся о правилах работы в химическом кабинете; развивать умение наблюдать, делать выводы.
• Воспитательная: Продолжить формирование умения высказывать свои взгляды, суждения, развития химической речи; формировать мировоззренческие понятия о познаваемости природы.
Тип урока: урок формирования новых знаний.
Форма урока: комбинированный урок.
Методы и методические приемы: объяснительно-иллюстративные (рассказ с элементами беседы, демонстрация презентации), создание проблемной ситуации, практическая работа.
Предполагаемые результаты обучения:
• знать: понятие «кислота», формулы кислот, классификацию кислот, признаки действия кислот на индикаторы; правила ТБ при работе с кислотами, химические свойства кислот.
• уметь: выбирать формулы кислот среди предложенных формул веществ, классифицировать кислоты по наличию кислорода, по числу атомов водорода, определять кислоту с помощью индикаторов, работать с растворами кислот, соблюдая правила техники безопасности, составлять химические уравнения реакций.
Оборудование:
• компьютер, мультимедийный проектор, презентация Power Point;
• набор для практической работы учащихся: штатив с пробирками, прибор для нагревания, индикаторы (лакмус, универсальная индикаторная бумага), растворы кислот HCl, H2SO4, основания NaOH, оксиды – CuO, соли CaCO3, Ba(NO3)2,таблетки аскорбиновой кислоты, яблоко, лимон.
• рабочий лист, содержащий задания и описания опыта.
• Ход урока
Деятельность учителя Деятельность учащихся
I. Организационный момент. (1-2 мин.)
II. Актуализация знаний.
Раздел «Воспоминаний» (10 мин.) слайд 4-9
Мы знакомимся с основными классами неорганических соединений. Вспомним, с какими классами веществ вы уже знакомы?
Загадка:
Если в паре элементов
Кислород вторым стоит,
Ты же знаешь, эта пара
Называется … (оксид).
Вопросы:
Что такое оксиды? Чем они отличаются от других классов веществ?
Загадка:
Если формулы начало
Представляется с металла,
ОН – красуется затем,
Вещества знакомы всем.
Не надо придумывать им название
Ведь эти вещества… (основания). Дают определение оксидам.
Вопросы:
Что такое основания? Как отличить основание от других классов? Дают определение основаниям. Объясняют что такое индикаторы.
Если видишь с водорода
Вдруг, да формула начнется,
То таких с десяток формул
Выучить тебе придется!
Вот эта видишь с кислородом,
Бескислородная вон та,
Но у них одна природа,
Все с названьем…. (кислота)!
Что такое кислоты? Где кислоты встречаются в природе? Как получают кислоты?
Задание:
Распределите формулы по классам в таблицу Работают по заданию в рабочем листе; распределяют предложенные формулы в таблицу по классам:
HCl, HNO3, H2SO4, Ca(OH)2, K2O, Na2O, Al2O3, Zn(OH)2, Al(OH)3.
Таблица 1.
ОКСИДЫ ОСНОВАНИЯ КИСЛОТЫ
III. Изучение нового материала.
Тема урока «Кислоты» Записывают в рабочем листе.
1) Классификация кислот (5мин.) (работа со слайдом №11).
Вопросы:
Чем отличаются приведённые пары кислот? На какие группы можно разделить кислоты? (слайды №12,№13, 14,15) Задание:
Чем отличаются приведённые пары кислот?
По примерам кислот называют признаки классификации.
Ответ:
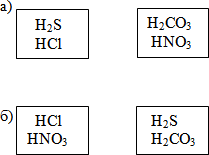
а) По наличию кислорода: бескислородные и кислородсодержащие (заполнение схемы 1 в рабочем листе).
б) По количеству водорода: одноосновные, двухосновные, трёхосновные (заполнение схемы1 и 2 в рабочем листе).
Вопрос:
Какие кислоты вам знакомы из жизненного опыта? Яблочная, лимонная, уксусная, молочная и др.
в) По происхождению: органические и неорганические.
2) Физические свойства кислот. (3 мин.)
а) Физические
Задание:
определить вкус аскорбиновой кислоты, рассмотреть агрегатное состояние вещества, внешний вид серной и соляной кислот и растворимость кислот в воде.
- вкус
- агрегатное состояние
- растворимость в воде Опытное определение вкуса аскорбиновой кислоты, яблочной кислоты и лимонной кислоты (В химической лаборатории запрещено вещества пробовать на вкус).
Выводы:
большинство кислот кислые на вкус
жидкости (исключение H2SiO3)
хорошо растворимые в воде (исключение H2SiO3)
3) Химические свойства кислот
б) Правила ТБ при работе с едкими веществами. (1 мин.) Слайд 20
в) Химические свойства кислот (форма работы: парная). (15 мин.)
Опыт1. Исследование окраски индикаторов в кислотных средах.
Опыт 2. Взаимодействие кислот с основаниями – реакция нейтрализации.
Опыт 3. Взаимодействие кислот с металлами.
Опыт 4. Взаимодействие кислот с солями.
Опыт 5 Взаимодействие кислот с оксидами
Выполнение опыта по описанию в рабочем листе. Исследование окраски индикаторов в кислотных средах и занесение результатов в таблицу 2. (проверка по слайду 21).
Работа в рабочих листах: Задание 2. Составление уравнений реакций.
4) Применение кислот. (1 мин.)
Медицина: аскорбиновая, фолиевая, линолевая, ацетилсалициловая (слайд 24).
IV. Закрепление знаний.
Рассмотрены ли вопросы намеченные по теме «Кислоты» (Состав,
классификация,
свойства. Повторение основных разделов темы: определение кислот; классификация; физические и химические свойства; правила ТБ.
Задание 3 на рабочем листе. (2 мин.) Индивидуальное выполнение заданий и взаимопроверка.
IV. Итог урока, рефлексия. (1 мин.)
Закончите предложение
«Урок был ...» Характеризуют урок, образуя разные формы от слова «кислый».
V. Домашнее задание (1 мин.)
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«конспект урока по химии"Получение и свойства кислот" »
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1770 руб.
2530 руб.
1970 руб.
2820 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства