
Г. Уссурийск 2014 г

Чтобы стать настоящим химиком, надо знать, уметь, думать!

А история простая…
Один учёный как-то раз,
Оксид какой-то нагревая,
Обнаружил странный газ –
Газ без цвета, без названья.
Ярче в нём горит свеча,
А не вреден ль для дыханья –
Не узнаешь у врача.
Новый газ из колбы вышел –
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит.
Наш учёный быстро пишет:
Воздух делится на части
(Эта мысль весьма нова).
Здесь у химика от счастья,
И у воздуха отчасти,
Закружилась голова.

- 1.Что является графическим отображением периодического закона?
- 2.Каков физический смысл порядкового номера?
- 3.Физический смысл номера периода?
- 4.Физический смыл номера группы?
- 5. На какие две большие группы делятся химические элементы?
- 6.Как называется связь, возникающая между атомами неметаллов?
- 7. Какую связь мы называем ковалентной полярной?
- 8. Что такое изотопы?

Цель:
- Познакомиться с распространением водорода в природе
- Познакомиться с историей открытия водорода
- Изучить физические и химические свойства водорода в сравнении с кислородом
- Рассмотреть основные области применения водорода

На долю
водорода
приходится
50 % массы
Солнца и других
звезд

1 %
99 %

В составе атмосферного воздуха присутствие водорода менее 0,0001 %

На долю
водорода
в воде
приходится
11%

Вода – Н 2 О
Метан - CH 4 Сероводород-
H 2 S

- Водород — самый распространённый элемент во Вселенной.
- На его долю приходится около 92 % всех атомов
- водород — основная составная часть звёзд и межзвёздного газа.
- В условиях звёздных температур водород существует в виде плазмы,
- в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов .
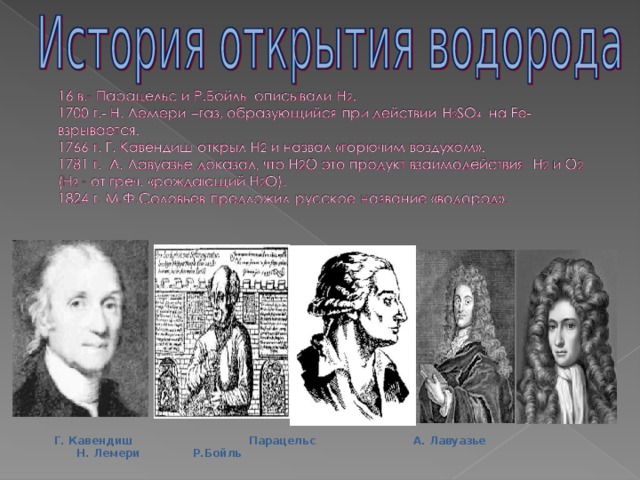
Г. Кавендиш Парацельс А. Лавуазье Н. Лемери Р.Бойль

Генри Кавендиш
Знаменитый английский физик и химик Г.Каведиш в 1766 исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы .

- Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и ее анализ, разложив водяной пар раскаленным железом.
Он установил, что «горючий воздух» входит в состав воды и может быть из нее получен.
В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество.
Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду».
.

- Русское название «водород» предложил химик М. Ф. Соловьев в 1824 году.
- На рубеже 18 и 19 века было установлено, что атом водорода очень легкий (по сравнению с атомами других элементов),
и вес (масса) атома водорода был принят за единицу.

- Молекула водорода двухатомна — Н 2 .
- При нормальных условиях — это газ без цвета, запаха и вкуса.
- Плотность 0,08987 г/л (н.у.),
- Температура кипения −252,76 °C,
- Малорастворим в воде — 18,8 мл/л.
- M (H 2 )= 2г/моль
- Степени окисления +1; 0; -1;
Кислород
Кислород
Химический знак
Химический знак
Относительная атомная масса
Водород
Относительная атомная масса
О
Водород
О
16
16
Молекула
Молекула
Относительная молекулярная масса
О 2
Относительная молекулярная масса
О 2
32
32
Молярная масса
Молярная масса
Валентность
32 г / моль
32 г / моль
Степень окисления
II
-2
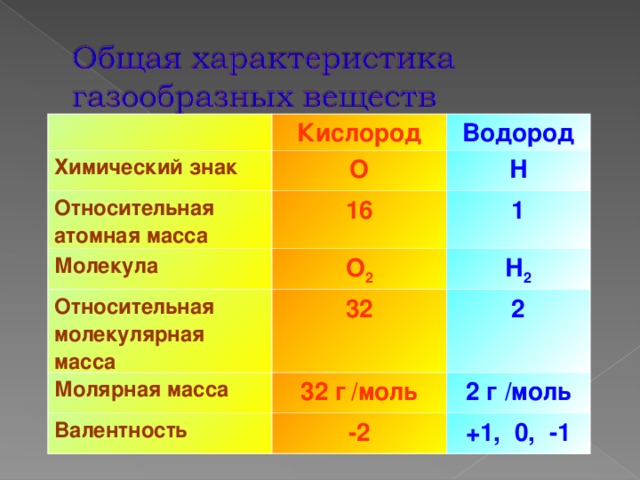
Кислород
Химический знак
Водород
О
Относительная атомная масса
16
Н
Молекула
1
О 2
Относительная молекулярная масса
32
Молярная масса
Н 2
2
32 г / моль
Валентность
-2
2 г / моль
+1, 0, -1

- Самый лёгкий газ на свете,
И в галактике он есть.
На воздушном шаре с газом
Можно к звёздам улететь.
_____________________________
- Без него мы жить не можем,
Он всегда нам всем поможет.
Он находится везде –
И на суше и в воде.
Кто же скажет мне из вас,
Как зовётся этот газ?
____________________________
Наверху проживаю,
В разных подъездах
Две квартиры занимаю.
Причем – под номером один!
Вот какой я господин!




В лаборатории:
- Взаимодействие цинка с соляной кислотой:
Zn+2HCl=ZnCl 2 + H 2
хлорид цинка
- Взаимодействие натрия с водой:
2 Na + 2H 2 O=2NaOH+H 2
гидроксид
натрия
В промышленности :
Разложение воды электрическим током:
2 H 2 O=2H 2 +O 2
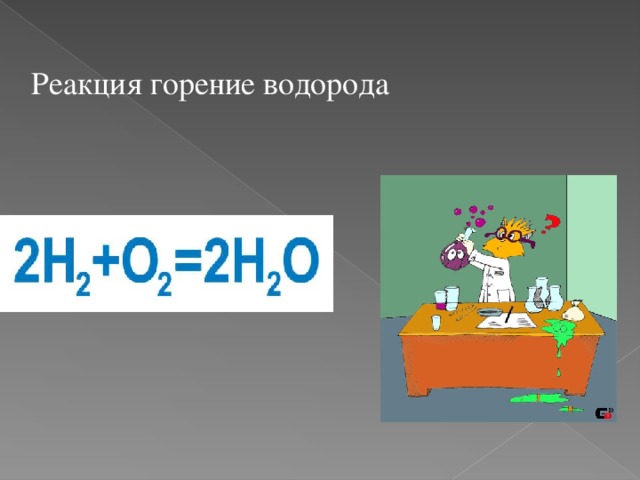
Реакция горение водорода

- Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ.
- при объёмном отношении водорода и кислорода 2:1,
- или водорода и воздуха приближённо 2:5
- Также водород пожароопасен.
- Жидкий водород при попадании на кожу может вызвать сильное обморожение.
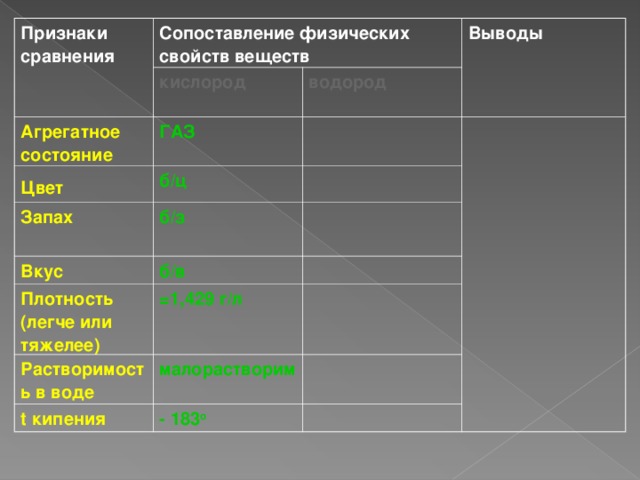
Признаки сравнения
Сопоставление физических свойств веществ
кислород
Агрегатное состояние
ГАЗ
Цвет
Выводы
водород
Запах
б / ц
б / з
Вкус
б / в
Плотность (легче или тяжелее)
=1,429 г / л
Растворимость в воде
малорастворим
t кипения
- 183 о
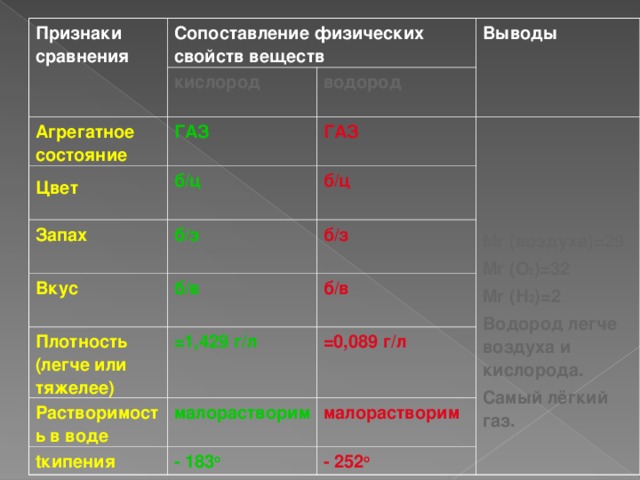
Признаки сравнения
Сопоставление физических свойств веществ
кислород
Агрегатное состояние
ГАЗ
Выводы
водород
Цвет
Запах
ГАЗ
б / ц
Вкус
Mr ( воздуха )=29
Mr ( О 2 )= 32
Mr ( Н 2 )=2
Водород легче воздуха и кислорода.
Самый лёгкий газ.
б / з
б / ц
Плотность (легче или тяжелее)
б / в
б / з
=1,429 г / л
Растворимость в воде
б / в
малорастворим
=0,089 г / л
t кипения
малорастворим
- 183 о
- 252 о

Заполнение воздушных шаров водородом

Признаки сравнения
Сравнение химических свойств газообразных веществ
Выводы
Водород Кислород
Соединения с простыми веществами:
а)с металлами
б)с неметаллами
1 Взаимодействие с кальцием
2Са+О 2 = 2СаО
оксид кальция
2 Взаимодействие с серой
S+O 2 =SO 2
Оксид серы( IV)
3 Взаимодействие с фосфором
4Р+5О 2 =4Р 2 О 5
Оксид фосфора( V)
4 Взаимодействие кислорода с водородом
2Н 2 +О 2 =2Н 2 О
Взаимодействие со сложными веществами.
Взаимодействие
с метаном(СН 4 )
Взаимодействие
с оксидом меди( II) СН 4 +2О 2 =СО 2 +2Н 2 О+ Q
Оксид оксид
углерода( IV) водорода
О 2 – окислитель
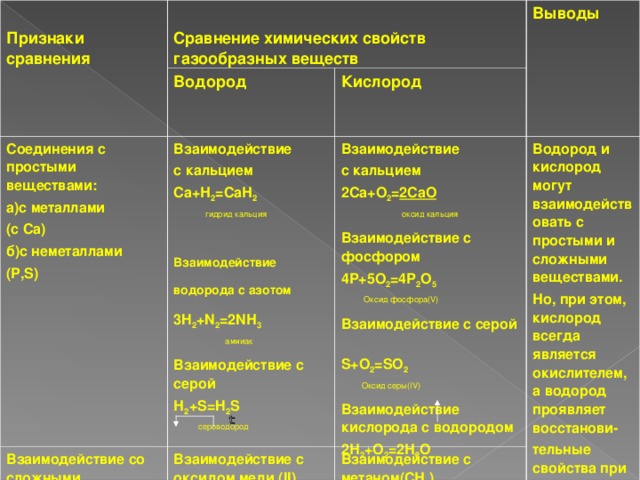
Признаки сравнения
Сравнение химических свойств газообразных веществ
Водород
Соединения с простыми веществами:
а)с металлами
(с Са)
б)с неметаллами
(P,S)
Взаимодействие со сложными веществами.
Кислород
Взаимодействие
с кальцием
Са+Н 2 =СаН 2
гидрид кальция
Взаимодействие водорода с азотом
3 H 2 + N 2 =2 N Н 3
аммиак
Взаимодействие с серой
Н 2 + S=H 2 S
сероводород
Выводы
Взаимодействие с оксидом меди ( II )
H 2 + CuO = Cu +H 2 O
черный красный
Взаимодействие
с кальцием
2Са+О 2 = 2СаО
оксид кальция
Взаимодействие с фосфором
4Р+5О 2 =4Р 2 О 5
Оксид фосфора( V)
Взаимодействие с серой
S+O 2 =SO 2
Оксид серы( IV)
Взаимодействие кислорода с водородом
2Н 2 +О 2 =2Н 2 О
Водород и кислород могут взаимодействовать с простыми и сложными веществами.
Но, при этом, кислород всегда является окислителем, а водород проявляет восстанови-
тельные свойства при взаимодейст-
вии с оксидами металлов.
Взаимодействие с метаном(СН 4 )
СН 4 +2О 2 =СО 2 +2Н 2 О+ Q
Оксид оксид
углерода( IV) водорода

Пронумеруйте 8 строчек в столбик. Записывайте возле каждого номера формулу нужного газа.
- 1. Легкий газ
- 2. Тяжелый газ
- 3. Газ, поддерживающий горение
- 4.Газ при смешивании с кислородом взрывается при обычных условиях.
- 5.Собирают вытеснением воздуха.
- 6. Собирают в опрокинутый вверх дном сосуд
- 7. Собирают методом вытеснения воды.
- 8. Собирают в сосуд, поставленный на дно.

- 1) Н 2 количество баллов :
- 2) О 2 «5»-10-9 отв.
- 3) О 2 . «4»- 8-7 отв.
- 4) Н 2 «3»- 6-4 отв.
- 5) Н 2 , О 2 .
- 6) Н 2 .
- 7) О 2 , Н 2
- 8) О 2 .

- § 16-17 ;
- Упр. 1-4
- Творческое задание «Почему Водород называют топливом будущего?»
- Решить задачу: найти объем водорода, полученного при взаимодействии 1 г цинка с соляной кислотой.

Удалось ли мне подняться на высоту звёзд в приобретении знаний о водороде.
Что нового вы узнали на уроке?
Что вам было не понятно?
Все ли пункты плана мы рассмотрели?
Все ли пункты плана мы рассмотрели?
Что нового вы узнали на сеянем уроке?
Что вам было не понятно?

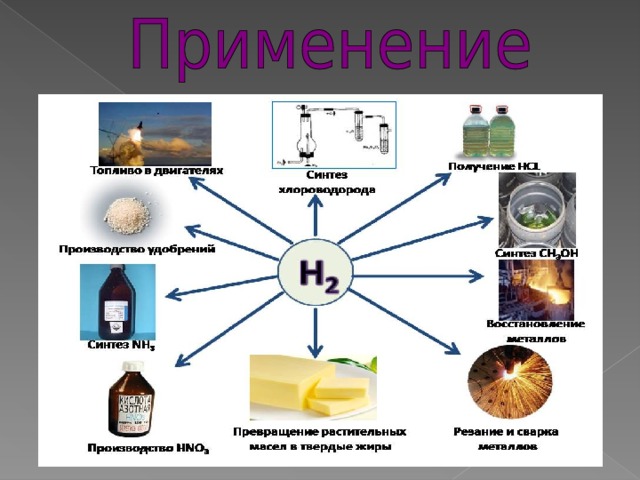
1. http://ru.wikipedia.org/wiki/ Водород
2. http://ru.wikipedia.org/wiki/ Аппарат_Киппа
3. http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/VODOROD.html
4. Рудзитис Г.Е. Химия. 8 класс. Учебник - 176 с., 2009г.
5. Л. Аликберова. Занимательная химия, Москва «АСТ-ПРЕСС», 1999
6. В.А. Крицман Книга для чтения по неорганической химии. Книга для чтения учащихся.- Москва: «Просвещение», 1993г. 1. http://himbio.ucoz.ru/index/illjustracii/0-21
2. http://www.alhimikov.net/video/neorganika/menu.html
3. http://sc.uriit.ru/catalog/rubr/eb17b17a-6bcc-01ab-0e3a-a1cd26d56d67/23511/
4. http://images.yandex.ru/yandsearch
5. http://www.youtube.ru




















































