Данный урок включает в себя план – конспекта урока и презентацию по теме « Физические и химические свойства водорода. Применение». Во время изучения данной темы будут использованы иллюстративные материалы, содержащие справочные данные по физико –химическими свойствами и применении водорода.
При изучении нового материала продолжается конкретизация знаний о химическом элементе и простом веществе. Используя план характеристики химического элемента учащиеся самостоятельно характеризуют водород как химический элемент.
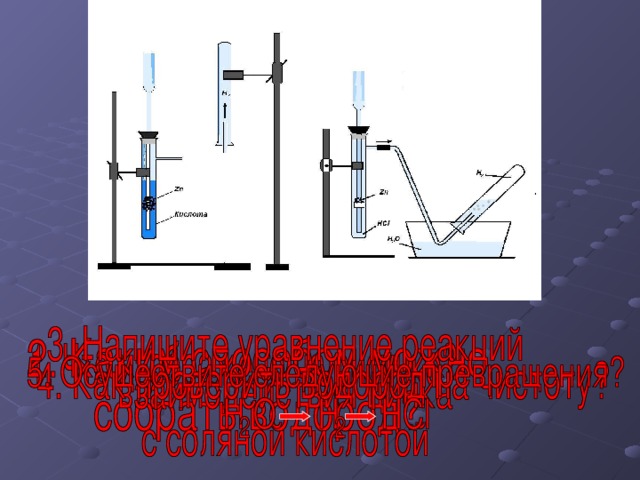
Далее учитель демонстрирует получение водорода в аппарате Киппа: объясняет устройство аппарата и показывает, как проверить водород на чистоту, разъясняет, почему работать с водородом опасно. Затем учитель демонстрирует способы собирания водорода. Учащиеся, наблюдая за демонстрационным экспериментом, отмечают физические свойства водорода. Обсуждение физических свойств водорода необходимо проводить в сравнении с физическими свойствами кислорода.
Говоря о том, что водород самый легкий из газов, можно продемонстрировать наполнение водородом мыльных пузырей. Готовят из туалетного мыла пену, в которую для прочности мыльных пузырей добавляют несколько капель глицерина.
Затем учитель подробно разбирает запись уравнения реакции получения водорода в лаборатории, отмечает, что эта реакция относится к реакциям замещения. Обращает внимание на формулы сложных веществ — соляной кислоты НСl и серной кислоты Н2SO4. Вводит понятие о валентности кислотного остатка. Затем учащиеся выполняют лабораторные опыты, закрепляя практические умения получать водород, собирать его вытеснением воздуха, проверять на чистоту, доказывать наличие образовавшейся соли.
Просмотр содержимого документа
«водород»
Республика Казахстан Восточно-Казахстанская область. г.Семей
«КГУ Средняя общеобразовательная школа №36»
Шарипхан Алма Ермеккызы учитель химии
Физические и химические свойства водорода. Применение.
Цель урока: Изучить физические, химические свойства водорода и его применение
Задача:
Вспомнив методом сравнения дать новые знания о свойствах водорода, рассказать о применений водорода
Актуализация самостоятельной деятельности учащихся .
Развития логико-смыслового мышления учащихся.
Оборудование и реактивы:
Презентация «физические, химические свойства водорода»
Пробирки, ученический штатив, прибор для получения газов, спиртовки, чашка Петри,
колбы, весы, спички.
Приемы и средство обучения:
Ход урока: І организационный момент.
Самопроверка готовности к уроку. Посмотрите слайд с информацией, дайте ответы на поставленные вопросы письменно в рабочих тетрадях. Действуйте самостоятельно, не используя ни какую помощь.
І – слайд. Вводный тест:
Что изображено на рисунке?
Каким способом можно собрать водород?
Напишите взаимодействия цинка с соляной кислотой?
Как проверить водород на чистоту?
Осуществите следующие превращения?
H2O → H2 →HCl.
Составьте уравнения соответствующих реакций
Поменяйтесь тетрадями с соседом по парте и сделайте проверку работ, сверяясь со слайдом №2. Количество баллов, исправление ошибок, дополнительные записи в тетради и ваши и вашим соседом.
Слайд №2 Ответы:
Получение водорода в лаборатории.
Водород собирают двумя способами, методом вытеснения воздуха и воды.
Zn + 2HCl → ZnCl2 + H2
Чтобы проверить водород на чистоту, пробирку с собранным водородом подносят к пламени спиртовки, и услышим характерный звук.
2H2O → 2H2 + О2
H2 + Cl2 → 2HCl
Тема: Физические, химические свойства водорода.
Предлагаю учащихся самостоятельно проработать § 31: 32 в учебнике
После этого выполняются опыты, показывающие химические свойства водорода?
Класс делится на три группы
І – группа. Используя учебник, и данные оборудования и реактивы, докажите физические свойства водорода.
ІІ – группа. Используя учебник, и данные оборудования и реактивы, покажите восстановление меди водородом из оксида меди (ІІ). Напишите уравнение реакций.
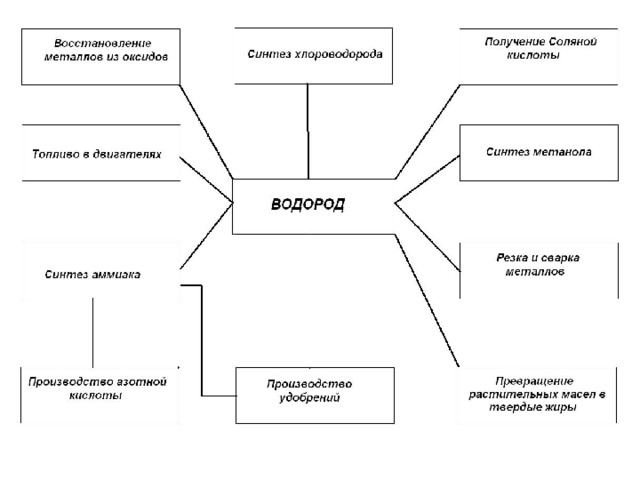
ІІІ – группа. Где применяется водород? Для этого заполним таблицу.
| Свойства | Применения |
| Самый легкий газ. Горит в кислороде. 2H2O → 2H2 + О2 Горит в хлоре Восстановив оксид металлов CuO + H2 → Cu + H2O
| Наполнения шаров Источник энергий Экологический чистый топливо Получить HCl.
Получают металлы |
Для того чтобы, обобщит тему, обратите внимания на следующие слайды.
Физические свойства водорода
Бесцветный газ?
Не имеет запаха?
Самый легкий газ?
В 14,5 раза легче воздуха?
Плохо растворим в воде?
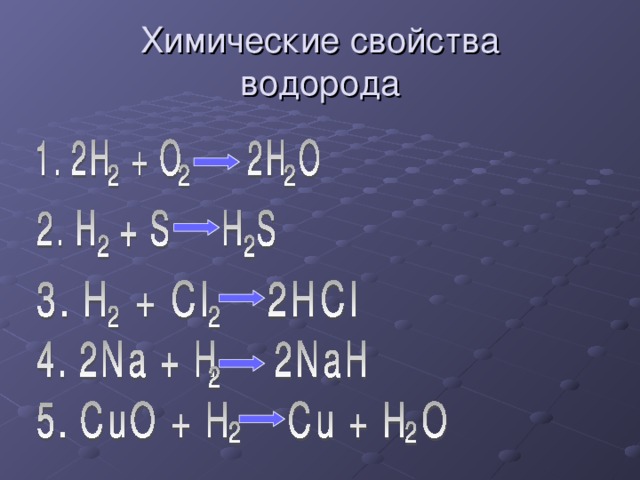
Химические свойства водорода
2H2 + О2 → 2H2O
H2 + Cl2 → 2HCl
H2 + S → H2S
2Na + H2 → 2NaH
CuO + H2 → Cu + H2O
Применения водорода
По таблице повторяем применение водорода.
Графический диктант.
Правильный ответ: 
Неправильный ответ: 
Водород самый тяжелый газ
Если он чистый, загорается со слабым звуком
Восстанавливает металлы из оксидов
Взаимодействует с водой
Применяется при сварке металлов
Соединяясь с серой, образует газ с запахом тухлого яйца
Распространенный элемент в воздухе
водород является дешевым топливом
Задание на дом: §31-32. Упр.5-6-7. Стр.88
Просмотр содержимого презентации
«Водород»