План конспекта урока «Его величество Кислород»»
ФИО учителя, образовательное учреждение, населенный пункт:
Миргород Светлана Леонидовна, МКОУ Григорьевская СОШ, Гусь-Хрустального района, Владимирской области
Предмет: химия
Название учебно-методического комплекса или иных пособий издательства «Русское слово», использованных при подготовке конспекта: УМК по химии для 9 класса И.И.Новошинского.
Класс: 9
Тема: Кислород.
Тип урока: урок – обобщение в форме командной игры
Цели:
Образовательные: Создание условий для обобщения и закрепления материала по теме «Кислород», отработки полученных умений записывать уравнения химических реакций, решать расчетные задачи;
Воспитательные: Создание условий для формирования умения работать в коллективе, воспитания взаимопомощи, положительного отношения к изучению химии, умений проводить взаимооценку;
Развивающие: Развитие познавательного интереса.
Задачи (шаги, с помощью которых достигаются цели урока):
-
Организовать продуктивную работу детей в группах с помощью заданий и вопросов по изученной теме;
-
Создать ситуацию успеха и взаимоподдержки детей через организацию работы в группах;
-
Поддерживать интерес с помощью разнообразных и интересных вопросов по теме обобщения;
-
Организовать взаимопроверку и оценку результатов работы.
Оборудование и материалы: проектор, компьютер, презентация, листы ответов и ключи для взаимопроверки.
Использованные источники (книги с указанием автора, названия, издательства, года издания; ссылки на сайты, с которых была взята информация для урока):
- И.И.Новошинский. Химия. 9 класс: Учебник для общеобразовательных учреждений /. И.И.Новошинский – М.:Русское Слово, 2013г.
- Единая коллекция цифровых образовательных ресурсов. Неорганическая химия. Видеоопыты.
Ход урока:
№
Этап урока
Деятельность учителя
Деятельность учеников
Дидактические материалы и средства
1
Мотивационный этап
Приглашает детей к участию в игре «Его величество Кислород», организует жеребьевку.
Рассаживаются по командам, готовятся к совместной деятельности: выбирают капитана, название команды, распределяют роли, изучают лист ответов
Слайд № 1-2
2
Этап подготовки учащихся к активному усвоению знаний
Сообщает цель урока, шкалу оценивания.
Готовятся к активной работе в команде.
3
Этап обобщения и систематизации
С помощью презентации демонстрирует вопросы по теме обобщения, вводит ограничение по времени для ответов на вопросы, в зависимости от сложности
Заполняют листы ответов, работая в командах.
Вопрос № 1
Укажите положение кислорода в ПСХЭ Д.И. Менделеева
Слайд № 3
Вопрос № 2
Кислород был открыт одновременно шведским химиком Карлом … и английским химиком Джозефом…
Слайд № 4
Вопрос № 3
Кислород – самый распространенный элемент на нашей планете, он входит в состав воздуха, воды, земной коры.
Соотнесите:
Литосфера 85,5%
Гидросфера 23%(по объему)
Атмосфера 49% (по массе)
Слайд № 5
Вопрос № 4
Валентные возможности кислорода:
В соединениях кислород обычно двухвалентен (в оксидах), валентность VI не существует. В свободном виде встречается в виде двух простых веществ: О2 («обычный» кислород) и О3… О3 – газ без цвета с резким запахом, с относительной молекулярной массой =48.
Это явление называется…
Слайд № 6
Вопрос № 5
Кислород находится на 2-месте по …
среди химических элементов Периодической системы Д.И.Менделеева после фтора.
Слайд № 7
Вопрос № 6
Максимальная степень окисления кислорода в соединениях.
Слайд № 8
Вопрос № 7
Кислород-жизненно важный для всех организмов элемент.
При его участии совершается один из важнейших процессов-…
Слайд № 9
Вопрос № 8
Физические свойства:
Кислород (простое вещество)-..
Без цвета и запаха, немного…
воздуха, … растворим в воде.
Слайд № 10
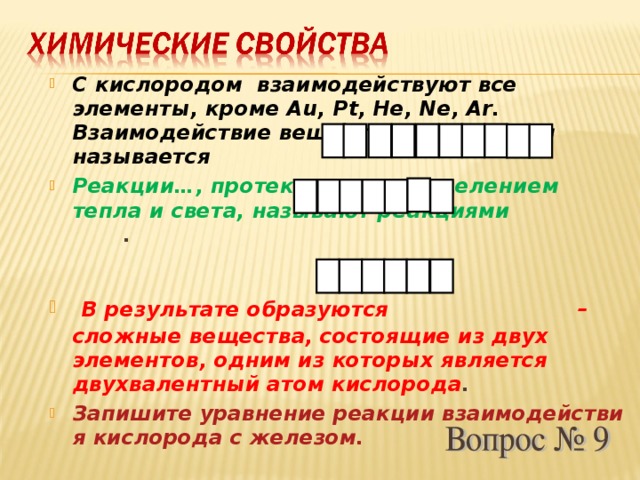
Вопрос № 9
С кислородом взаимодействуют все элементы, кроме Au, Pt, He, Ne, Ar. Взаимодействие веществ с кислородом называется…
Реакции…, протекающие с выделением тепла и света, называют реакциями … .
В результате образуются… – сложные вещества, состоящие из двух элементов, одним из которых является двухвалентный атом кислорода.
Слайд № 11
взаимодействие кислорода с железом.
Вопрос № 10
Кислород реагирует со сложными веществами, образуя при этом оксиды.
Запишите уравнение реакции взаимодействия сульфида железа (пирита) с кислородом.
Слайд № 12
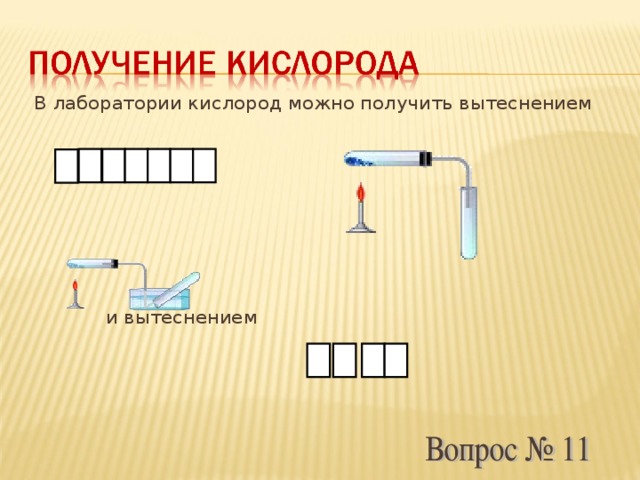
Вопрос № 11
В лаборатории кислород можно получить вытеснением …, и вытеснением …
Слайд13
Разложение перманганата калия (марганцовка):
Вопрос № 12
Получение кислорода
в лаборатории
1) Разложение перманганата калия (марганцовка):
2) Разложение перекиси водорода:
2H2O2 MnO2® 2H2O + O2↑
3) Разложение бертолетовой соли:
2KClO3 t?C , MnO2® 2KCl + 3O2↑
Получение в промышленности
1) Электролиз воды
2H2O эл. ток® 2H2 + O2↑
2) Из воздуха
ВОЗДУХ давление, t=-183?C® O2 (голубая жидкость)
Запишите уравнение реакции получения кислорода из перманганата калия.
Слайд № 14
Вопрос № 13
Перечислите области применения кислорода.
Слайд №15
Вопрос № 14
В природе кислород образуется в процессе…
который происходит в зелёных растениях на свету. В целях сохранения кислорода в воздухе вокруг городов и крупных промышленных центров создаются зоны зелёных насаждений. Запишите уравнение этой реакции.
Слайд № 16
Вопрос № 15
Решите задачу:
Определите объем кислорода, необходимого для сжигании 64 г. серы.
Слайд № 17
4
Этап оценивания и подведения итогов
Организует взаимооценивание команд, раздав ключи к вопросам
По разбалловке, предложенной учителем оценивают лист ответа другой команды.
5
Этап информации о домашнем задании
выполнить упражнения № 1-4 после § 21
Записывают домашнее задание
КЛЮЧИ
№
Вопроса
ОТВЕТ
Баллы
1
Порядковый номер 8, группа VIА, период 2
1
2
Шееле, Пристли.
2
3
1-49%, 2-85,5%, 3-23%
1
4
Озон, аллотропия
1
5
Электроотрицательность
1
6
-2
1
7
дыхание
1
8
Газ, тяжелее, мало
1
9
Окислением, горения, оксиды, 2Fe + O2 =2FeO
3
10
4FeS2 +11O2 =2Fe2O3 +8SO2
2
11
Воздуха, воды
1
12
2KMnO4 = K2MnO4 + MnO2 +O2
1
13
Резка и сварка металлов, медицина, металлургия, окисление ракетного топлива, взрывные работы, на подводных лодках для дыхания.
1
14
фотосинтеза
1
15
44,8л.
2
ИТОГО:
20
Если команда набрала 18 – 20 баллов, ставится оценка «5»,
14 –17 баллов, ставится оценка «4»,
10 – 13 баллов, ставится оценка «3»,
0 – 9 баллов, ставится оценка «2».
Разрешается добавить балл команде за оригинальное название, связанное с темой «Кислород». Команда теряет баллы в случае плохого поведения.
ОТВЕТЫ КОМАНДЫ
Название команды:
№
Вопроса
ОТВЕТ
Количество баллов
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
ИТОГО:
Если команда набрала 18-20 баллов, ставится оценка «5»,
14-17 баллов, ставится оценка «4»,
10-13 баллов, ставится оценка «3»,
0 –9 баллов, ставится оценка «2».
Разрешается добавить балл команде за оригинальное название, связанное с темой «Кислород».
Команда теряет баллы в случае плохого поведения.