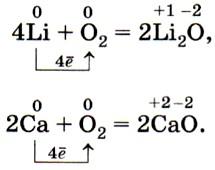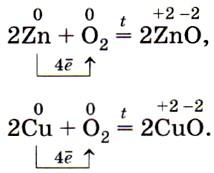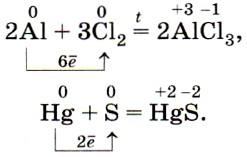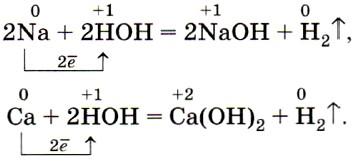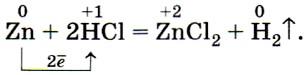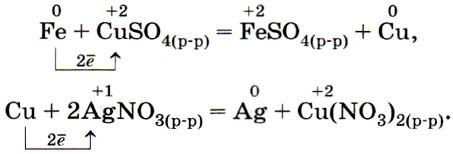Запись в тетрадь
Рассказ
Запись в тетрадь
Рассказ
Запись в тетрадь
Рассказ
Запись в тетрадь
Рассказ
Запись в тетрадь
Рассказ
Запись в тетрадь
Рассказ
Рассказ
Рассказ
Рассказ
Конспект по химии на тему:
«Химические свойства металлов как восстановителей»
Цель урока: дать представление об электрохимическом ряде напряжения металлов, актуализировать знания о химических свойствах металлов, формировать умения составлять уравнения химических реакций с участием металлов.
Задачи урока:
Образовательные: формирование знаний учащихся о химических свойствах металлов, о способности металлов взаимодействовать с простыми и сложными веществами, определять взаимосвязи химических свойств металлов со строением их атомов.
Развивающие: формирование у обучающихся умения выделять главное, существенное в изучаемом материале; сравнивать, обобщать, систематизировать, компактно и логически последовательно излагать свои мысли.
Воспитательные: формирование интереса к предмету химии, воспитывать отношение к химии как к одному из фундаментальных компонентов естествознания.
Тип урока: урок изучения нового материала
Оборудование: Габриелян, О. С. Химия. 9 класс. Базовый уровень / О. С. Габриелян. – М. : Дрофа, 2014. – 319 с.
Методы обучения: словесные, наглядные, работа с учебником.
Основные понятия: электрохимический ряд напряжений, восстановительные свойства металлов.
Формы работы: фронтальная, индивидуальная.
План урока:
1. Организационный момент (3 мин)
2. Актуализация знаний и умений (10 мин)
3. Формирование новых знаний (25 мин)
4. Закрепление изученного материала (3 мин)
5. Домашнее задание (2 мин)
6.Подведение итогов (2 мин)
I. Организационный момент.
Здравствуйте, ребята! Садитесь.
II. Актуализация знаний и умений
На прошлом уроке мы с вами изучали положение металлов в Периодической системе Д. И. Менделеева и строение их атомов. Сейчас мы повторим изученное.
Фронтальный опрос:
1. Положение металлов в ПСХЭ.
2. Как меняются металлические свойства в группе главной подгруппе и в периоде?
3. Какими свойствами (окислительными или восстановительными) обладают металлы? Почему?
4. Как меняются восстановительные свойства металлов в А группе и периоде? Почему?
5. Перечислите общие физические свойства металлов (металлический блеск, пластичность, ковкость, электро- и теплопроводность, цвет – серебристо-белый или серый).
Задание:
По теме урока: Положение металлов в Периодической системе Д. И. Менделеева и строение их атомов.
Этап урока: контрольно-оценочный
Цель задания. Формировать умения классифицировать.
Прием ТРИЗ «Я БЕРУ С СОБОЙ….»
Известно, что щелочные металлы растворяются в воде (большинство из них со взрывом !). Вам необходимо по тонкой жердочке перенести на другой берег реки только металлы, при этом они не должны растворяться в воде.
Если вы взяли лишние элементы – это означает, что вы упали в реку. Итак, кто же останется сухим!
«БЕРУ С СОБОЙ….»
Na
S
Fe
As
Al
Cu
P
Zn
C
B
Rb
Cs
Ответ:
Берем с собой: Аl, Zn, Fe, Cu
Не берем с собой: неметаллы: As, P, B, S, C, а также растворимые в воде щелочные металлы: Na, Rb, Cs
III. Формирование новых знаний
Итак, мы с вами повторили прошлую тему, и начинаем изучение нового материала.
Открываем тетради, записываем сегодняшнее число и тему урока «Химические свойства металлов как восстановителей».
В химических реакциях металлы проявляют только восстановительные свойства, т. е. их атомы отдают электроны, образуя в результате положительные ионы. Окислителями при этом могут выступать неметаллы (кислород, галогены, сера и др.), катионы водорода Н+ и катионы других металлов.
С кислородом воздуха легко взаимодействуют щелочные и щёлочноземельные металлы (поэтому их хранят под керосином):
Железо, цинк, медь и другие менее активные металлы энергично окисляются кислородом только при нагревании:
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
Как вы уже знаете, металлы образуют с неметаллами бинарные соединения — оксиды, хлориды, сульфиды, фосфиды ит. д., например:
Щелочные и щёлочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:
Менее активные металлы, например железо, взаимодействуют с водой только в раскалённом виде:
3Fe + 4H2O = Fe3O4 + 4H2↑
При этом, как и при горении железа, получается оксид состава Fe3O4 (железная окалина), который представляет собой смесь двух оксидов FeO • Fe2O3.
По восстановительной способности, как вы уже знаете, металлы располагают в ряд, который называют электрохимическим рядом напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
В этот ряд помещён и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н+.
Как вы, очевидно, помните из курса химии 9 класса, из положения металлов в ряду напряжений вытекают два правила, характеризующие химические свойства металлов. Повторим их.
1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот (рис. 35), а стоящие правее, как правило, не вытесняют водород из растворов кислот:
Известно, что золото, ртуть и серебро не реагируют с соляной кислотой. Напомним, что это правило имеет ряд поправок:
· правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
· концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по-особому, при этом водород не образуется;
· на щелочные металлы правило не распространяется, так как они легко взаимодействуют с водой (а указанное правило относится к реакциям водных растворов кислот с металлами).
2. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например (рис. 36):
Это правило также имеет поправки, аналогичные таковым к первому правилу, а именно – правило соблюдается при условии образования растворимой соли; правило не распространяется на щелочные металлы.
IV. Закрепление изученного материала:
Закончить уравнения возможных реакций:
2Li + S→ Li₂S
2Li + 2H₂O → 2LiOH + H₂
Mg + HCl → MgCl2 + H2
Ag + H3PO4 → 2AgPO4 + 6H2
Cu + ZnCl2 → CuCl2 + Zn
Zn +AgNO3 → Zn(NO3)2 + Ag
V. Домашнее задание: §8 упр. 5,7 стр.42
VI. Подведение итогов:
В ходе урока были выполнены поставленные задачи. Изучили химические свойствами металлов, а также электрохимический ряд напряжений.
VII. Рефлексия:
ТЕЛЕГРАММА
Кратко написать самое важное, что уяснил с урока; написать пожелание своим товарища или себе.