| Дата | Предмет химия Класс 10 ЕМ Урок 14
Учитель химии Новохатская А.Н. КГУ «Гимназия №15» г.Алматы |
| Название занятия | Гибридизация атомных орбиталей (sp, sp2, sp3 гибридизации) и геометрия молекул. Зависимость свойств веществ от химического, электронного и пространственного строения молекул, взаимного влияния атомов. |
| Общие цели и задачи | Цель: сформировать основные понятия по теме «Гибридизация атомных орбиталей (sp, sp2, sp3 гибридизации) и геометрия молекул. Зависимость свойств веществ от химического, электронного и пространственного строения молекул, взаимного влияния атомов»; обобщить знания учащихся о строении неорганических веществ. Обучающая: обобщить и пополнить знания учащихся об электронном, пространственном строении неорганических веществ, о явлении гибридизации и геометрии молекул Развивающая: Развитие «химического» мышления помощью ТКРМ, умения использовать терминологию, ставить и разрешать проблемы. Анализировать, сравнивать, обобщать и систематизировать информацию. Воспитывающая: Формирование интереса к учению, стремления добиваться успеха в учебе за счет добросовестного отношения к своему труду, создание положительной психологической атмосферы, воспитание чувства взаимного уважения между ребятами для максимального раскрытия их способностей на уроке. Воспитывать взаимоуважение при работе в группе. |
| Ключевые идеи | Гибридизация атомных орбиталей (sp,sp2, sp3 гибридизации) и геометрия молекул. Пространственное строение веществ. |
| Источники | Учебник химии 10 ЕМ класса Н.Н. Нурахметов, К. Бектуров, Н.А. Заграничная, Г.В. Абрамова |
| Материалы и оборудование | ИКТ. Компьютер, проектор, экран, презентация. Раздаточный материал к уроку. Периодическая система химических элементов. |
| Ход занятия
|
| Этапы проведения занятия | Время | Действия учителя и действия учеников |
| 1.Организационный момент.
|
1 мин. | |
| 2. Мотивация | 1 мин. | Итак, ребята, вы уже познакомились на предыдущих уроках с видами химических связей, типами кристаллических решеток, а также зависимостью свойств веществ от их строения. Сегодня мы обобщим изученный ранее материал и продолжим знакомство с явлением гибридизации и геометрией молекул
Сообщение темы урока, постановка познавательных задач для учащихся. Тема урока записана на доске. |
| 3. Актуализация Формативное оценивание (самооценивание)
Стадия Вызова Вызывает уже имеющиеся знания, задаёт вопросы по ранее изученному материалу, обсуждает полученную от учащихся информацию.
| 10 мин.
| 1.Проверка домашнего задания (учащимся выданы правильные ответы) | 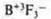
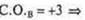 в атоме три неспаренных электрона; в атоме три неспаренных электрона;
 в молекуле 3 σ-связи в молекуле 3 σ-связи
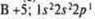
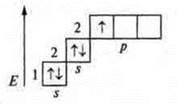
Один неспаренный p-электрон, а необходимо три. В атоме происходит распаривание: 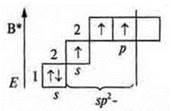
Три неспаренных электрона, 1s-электрон и 2p-электрона. sp2-гибридизация: три гибридных орбитали; угол 120°. 
| 
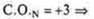 в атоме три неспаренных электрона; в атоме три неспаренных электрона;
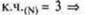 в молекуле 3 σ-связи в молекуле 3 σ-связи
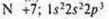
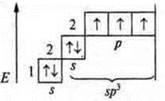
В атоме три неспаренных электрона, в гибридизацию вступают пара спаренных электронов 2s и три неспаренных p-электрона; sр3-гибридизация. Четыре гибридных орбитали. Направление в пространстве 109°28': 
На этой модели отмечаем три сигма связи: 
| | Геометрия молекулы — плоский треугольник: 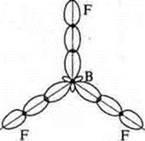
F +9: 1s22s22p5 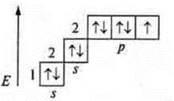
1 p-электрон | F +9; 1s22s22p5 
1 неспаренный p-электрон 
Тригональная пирамида; угол 107°, уменьшается за счет действия повышенной плотности атома азота, имеющего неподеленную пару электронов | 2.Задание на ассоциации. Заполните таблицу. |
Вопросы
|
Ответы
|
Дополнения и исправления
| | 1. Почему ковалентная связь разделена на два подвида? |
|
| | 2. Вещества, какого строения (связь, решетка) хорошо растворимы в воде? |
|
| |
3. Объясните, почему возникает гибридизация?
|
|
| | 4. В чем особенность водородной связи? |
|
| | 5. Почему металлы проявляют сходные свойства? |
|
|
Во время взаимопроверки ответов учащиеся ставят по 1 баллу за верно выполненное задание. Таким образом, они могут максимально получить 5 баллов.
|
| 4. Формирование новых знаний и их применение. Формирование умений и навыков.
Стадия осмысления.
Рассказывает содержание нового материала, ведёт записи на доске, поддерживает интерес учащихся к теме.
| 25мин. | Электронная презентация: Гибридизация атомных орбиталей. Геометрия молекул.
Задания учащимся: Задание I а) Определить тип химической связи в следующих соединениях, дать обоснованный ответ. СО2; NaCl; Mg; H2S; CCl4; СО; б) В соединениях СO2 и СО определить тип гибридизации и геометрию молекул. Если учащиеся готовы с ответом у доски, то необходимо их выслушать, а затем проверить работу, выполненную учащимися класса. В качестве контроля учитель предлагает правильно выполненные задания. Ответы на задание. 1) Металлическая связь — Mg; простое вещество — металл. Ионная связь — NaCl; соединение образовано металлом Na, неметаллом Сl, которые резко отличаются в ЭО. Коваленткая полярная связь — ССl4; H2S; СO2; СО. Соединения образованы атомами неметаллов, которые отличаются в ЭО не резко. | 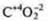 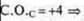 4 неспаренных электрона в атоме; 4 неспаренных электрона в атоме;  2 σ-связи в молекуле 2 σ-связи в молекуле С +6; 1s22s22p2  Два неспаренных электрона, а необходимо — четыре, идет распаривание двух s-электронов 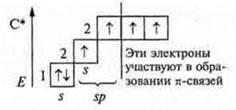 В гибридизации участвуют две орбитали s- иp-, так как 2σ-связи; sр-гибридизация, 180°  линейная форма молекулы |   в атоме 2 неспаренных в атоме 2 неспаренных
электрона;  в молекуле 1 σ-связи в молекуле 1 σ-связи С +6; 1s22s22p2 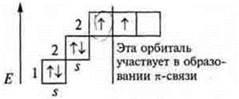 Один неспаренный электрон, а необходимо три, происходит распаривание 2s-электронов 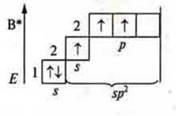 В гибридизацию вступают 2s-орбиталь и 2р-орбиталь; sp- гибридизация  линейная форма молекулы | | 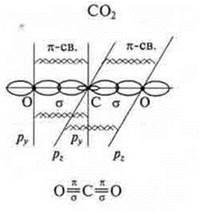 |  1 σ-связь; 1 π-связь одна связь по донорно-акцепторному механизму |
Учащиеся самостоятельно сверяют, определяют свои ошибки, исправляют ответы на вопросы.
Самостоятельная работа. Определить тип гибридизации и геометрию молекул по алгоритму Вариант 1 Вариант 2 OF2 NH3
Ответы на самостоятельную работу Вариант I 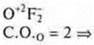 2 неспаренных электрона в атоме; 2 неспаренных электрона в атоме; 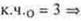 2σ-связи в молекуле. 2σ-связи в молекуле. 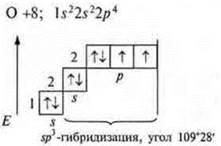 В гибридизации участвуют орбитали s- и р-. 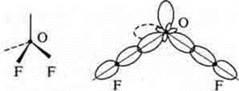 Выделяем две связи: угловая форма молекулы Вариант II 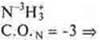 три неспаренных электрона в атоме; три неспаренных электрона в атоме;  3 σ-связи в молекуле. 3 σ-связи в молекуле. 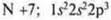 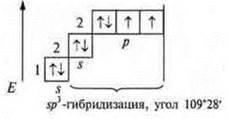 В гибридизации участвуют s- и р-орбитали; sp3-гибридизация, угол 109°28’ четыре гибридные орбитали.  Выделяем три связи. Выделяем три связи. Тригональная пирамида в атоме азота в вершине пирамиды, угол гибридизации изменяется за счет пары электронов азота и становится 107°. 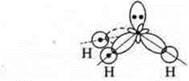 Перекрывание орбиталей |
| 5. Рефлексия. Подведение итогов урока. Помогает проанализировать изученную информацию, установить причинно - следственные связи между блоками информации. | 7 мин. | Составить синквэйн. Правила написания синквэйна:
В первой строчке тема называется одним словом (существительным). Вторая строчка – это описание темы в двух словах (два прилагательных). Третья строчка – описание действия в рамках темы тремя глаголами. Четвертая – это фраза из четырех слов, показывающая отношение к теме. Пятая - синоним из одного слова, который повторяет суть темы.
Что нового вы узнали на уроке? Что вызвало затруднение? Учащиеся сдают оценочный лист. Учитель дает оценку работе класса в течение урока. Отмечает лучшие ответы. |
| 6. Информация о домашнем задании. | 1мин. | Учитель информирует о домашнем задании, дает консультацию. Учебник § 2.3 №2,3 стр.53 Определить тип гибридизации и геометрию ClF3; SCl4; |



















 Выделяем три связи.
Выделяем три связи.
















