Электролитическая диссоциация кислот, оснований и солей
Тип урока Комбинированный
Цели урока
Закрепить понятия электролит, неэлектролит, электролитическая диссоциация. Познакомить учащихся с основными положениями электролитической диссоциации, сформировать навык составления уравнений электролитической диссоциации кислот, оснований и солей.
Задачи урока
1. Развитие представлений о классах неорганических веществ с точки зрения ЭД
2. Формирование представлений о процессах, происходящих с электролитами в ходе ЭД.
3. Развитие умений выдвигать гипотезы, устанавливать причинно-следственные связи.
4. Развитие умений создания и осмысления моделей на примере процесса электролитической диссоциации.
Знания, умения, навыки и качества, которые актуализируют/приобретут/закрепят/др. ученики в ходе урока
Ученики приобретут знания: классификация веществ-электролитов; механизм диссоциации веществ с ковалентной полярной и ионной химической связью;приобретут умения: составлять уравнения диссоциации кислот, оснований и солей. Закрепят: знания об электролитах и неэлектролитах, электролитической диссоциации; навык использования таблицы растворимости для решения учебных задач. Актуализируют: номенклатуру неорганических веществ; навыки работы с моделями; навыки работы с химическими веществами. Продолжат формировать качества: аккуратность, внимательность, способность переключаться с одного вида деятельности на другой, умения выдвигать гипотезы и грамотно излагать свои мысли.
Необходимое оборудование и материалы
Компьютер, проектор, магнитная доска и магниты, таблица растворимости кислот, оснований и солей, конверты с карточками-заданиями к уроку, презентация к уроку.
Реактивы: в мерных стаканах растворы щёлочи (NaOH), кислоты (HCl), лакмус, фенолфталеин.
Подробный конспект урока
1. Организационный момент.
Приветствие класса, проверка готовности класса к уроку, отметить отсутствующих
2. Повторение и актуализация знаний учащихся.
Ребята, на прошлом уроке вы познакомились с такими группами веществ как электролиты и неэлектролиты.
Давайте вспомним, какие вещества называют электролитами, а какие неэлектролитами? Ученик: Электролиты – это вещества, растворы или расплавы которых проводят электрический ток. Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток). Правильно. Теперь выполним небольшое задание. В конвертах на вашем столе находятся розовые карточки с заданиями для каждого ученика.
Карточка №1 Подчеркните формулы (названия) электролитов.
А. MgCl2, Li2O, HNO3, O2, NaOH, керосин.
Б.сульфат меди (II), нитрат калия, карбонат кальция, кислород, серная кислота, бензин, оксид кремния (IV), гидроксид меди (II), гидроксид натрия.
На выполнение задания 1 минута, затем проверим, что у вас получилось. Ученик отвечает по заданию А, называет вещества – электролиты и неэлектролиты. Почему сделан такой выбор? Обоснуйте ответ.
Ученик: Потому что хлорид магния – это растворимая соль, азотная кислота – растворима, гидроксид натрия – растворим. Остальные вещества или нерастворимы в воде, или не имеют заряженных частиц в своём составе. Кислород – неполярная ковалентная связь, а про сахар знаем из опыта.) Проверка (слайд № 4)
Ребята, а какие вам известны классы веществ? (оксиды, кислоты, основания, соли, металлы, неметаллы). На доске вывешиваются п л а к а т ы с названиями классов веществ. Как вы думаете, есть ли ещё какие-то классы веществ, которые мы с вами не изучали? Ученики предполагают, что такие классы есть.
Обозначим эти классы так ?.
Представители каких классов могут быть электролитами? Ребята обсуждают вопрос в малых группах, выдвигают гипотезы, результат отображается на доске: убрать Металлы и неметаллы, оксиды. Оставить только кислоты, основания, соли Другие классы - ? мы не можем сейчас дать ответ на этот вопрос, так как не знаем особенностей этих веществ. Теперь давайте вспомним, что же происходит с электролитами при растворении в воде или при расплавлении. Ученик: Они распадаются на ионы.
Как называется процесс распада электролита на ионы?
Ученик: Электролитическая диссоциация.
Ребята, скажите, а есть ли различия в процессах диссоциации веществ с ионным типом химической связи и веществ с ковалентной полярной связью? Ученики: предполагают что есть.
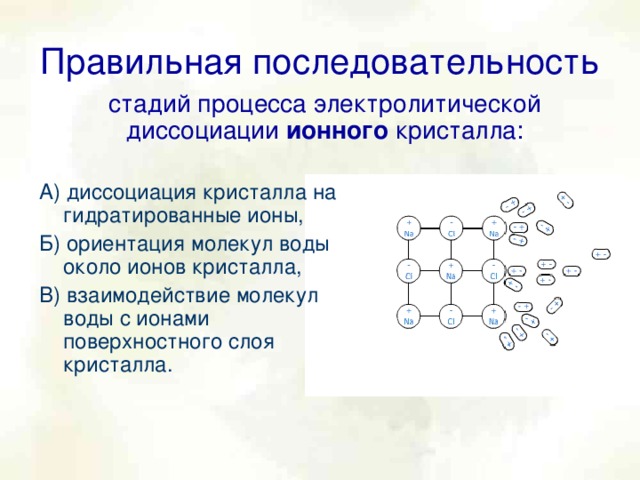
Различия есть. Ребята, выполним ещё одно упражнение. Укажите правильную последовательность стадий электролитической диссоциации ионного кристалла. (презентация, слайд № 5)
Обсуждение в парах, ответ ученика: Правильная последовательность БВА.
Теперь похожее задание для вещества с ковалентной полярной связью. Видим, что добавляется ещё одно действие: ионизация молекулы хлороводорода.
Правильная последовательность: БГАВ (презентация, слайд 6)
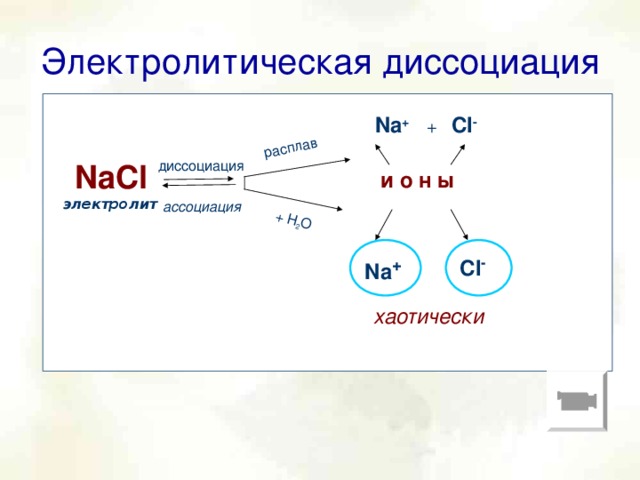
Возможно ли составить обобщённую модель процесса электролитической диссоциации? (ребята работают в малых группах (4 человека), отвечают на вопросы учителя, предлагают варианты записи условных обозначений) Как выразить графически обозначение электролита? – варианты ответов. Сначала предложим какой-либо конкретный вариант: например NaCl (внимание на слайд: первый щелчок – NaCl электролит).Что происходит с этим веществом при диссоциации? – оно распадается на ионы, т.е. диссоциирует (модель). Укажем условия: при растворении в воде или расплавлении! ведь при высоких температурах также происходит разрушение связей, (раствор; + Н2О). Какие частицы образуются в результате диссоциации – ионы.
Есть ли сходства и различия между ионами, образовавшимися в результате расплавления и растворения электролита? – Вопрос ученикам. Выяснение истины в ходе рассуждения. Сходство: электролит распадается на положительные и отрицательные ионы, они находятся в постоянном движении, движутся хаотически.
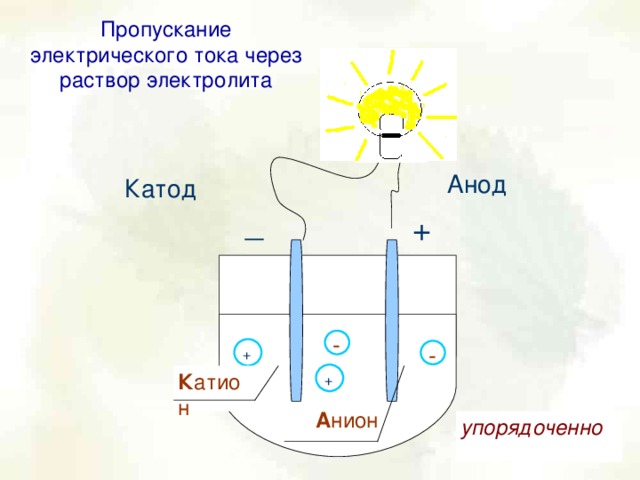
Различия: в расплаве ионам мешает воссоединиться тепловая энергия, а в растворах – гидратная оболочка. Покажем это различие на нашей модели. Обозначим гидратную оболочку вокруг символа иона. Обратим ли этот процесс? При каких условиях? – Да, обратим, если выпарить воду или остудить расплав. Тогда на нашей модели мы покажем этот процесс. Как он называется – ассоциация. Ребята, а как можно доказать наличие свободных ионов в растворах или расплавах? Подумайте… Вариант ответа учащихся – появление электрического тока. Обратимся к эксперименту, в котором, правда, в качестве примера использовано не ионное соединение а соединение с ковалентной полярной связью, но мы – то с вами уже знаем, что электропроводность свойственна и этим веществам. (Видеофрагмент). Почему в одних случаях лампочка загоралась, а в других – нет? Есть электрическая проводимость, т.е. электрический ток. Вспомним уроки физики: что такое электрический ток? Ученик: это упорядоченное движение заряженных частиц. Значит, в стаканчиках с растворами есть свободные подвижные заряженные частицы (ионы). Но, обратите внимание движение, уже не хаотическое, а упорядоченное. Отразим этот факт в нашей модели. В раствор электролитов опускали два электрода, которые имеют своё название: отрицательный – катод и положительный – анод (слайд – модель прибора). Можно предположить, что положительно заряженные ионы стали притягиваться к отрицательному электроду – катоду, их называют катионами, а отрицательные ионы – к аноду – их называют Анионами. Движение ионов стало упорядоченным!
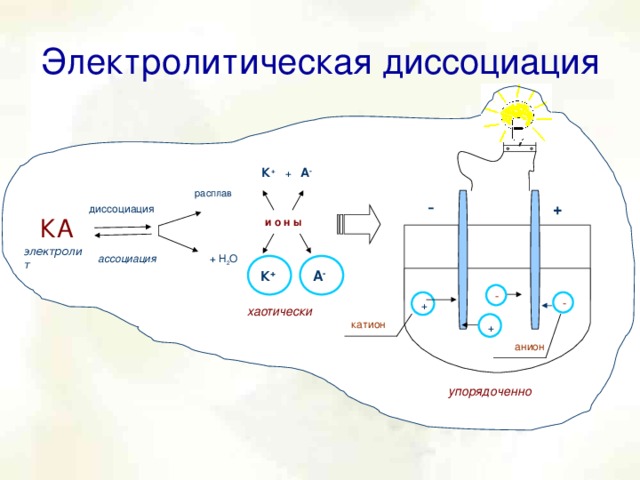
Скажите, пожалуйста, где находит применение процесс который мы с вами сейчас рассмотрели? - гальванические элементы, в медицине (электрофорез). Теперь объединим полученные модели в одну и получим общую модель, отражающую процесс электролитической диссоциации и явлений, её сопровождающих.
Представим любое вещество из группы электролитов как буквенное выражение КА (уточним обозначение электролита на нашей модели: объясним буквенное выражение КА - Катион и Анион) Слайд № 9. Ученики комментируют созданную модель, другие ученики исправляют неточности, ошибки.
В ваших конвертах есть эти модели на отдельных карточках. Каждый дома постарается по ней рассказать то, что узнал на сегодняшнем уроке. Таким образом, ребята, мы сейчас с вами сформулировали основные положения теории электролитической диссоциации. Назовите их ещё раз, и для этого воспользуйтесь рабочим листком из ваших конвертов. Внимательно читаем и вписываем пропущенные слова: ученики читают задания, обдумывают ответы (1 мин), записывают ответы. Рефлексия:
Электролиты при растворении в воде (расплавлении), распадаются (диссоциируют) на положительные и отрицательные ионы.
Причиной диссоциации электролита в водных растворах является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, и называются катионами . Отрицательно заряженные ионы – к аноду, их называют анионами.
3. Новый материал.
А теперь вспомним, что на уроках химии мы используем модели и другого вида, с использованием химических формул и математических знаков. Кто скажет, о чём идёт речь? Ученики: Это уравнения химических реакций. Ученики предполагают, что можно записать уравнением и процесс диссоциации электролита. Ребята, используя известные им правила составления уравнений химических реакций, составляют уравнения электролитической диссоциации хлорида натрия. (Слайды №11-13)
Пример рассуждения: исходное вещество – NaCl, процесс обозначает à, продукт – катионы Na+ и анионы кислотного остатка Cl-. Оформляем запись на доске: NaCl à Na+ + Cl-.
Анализируем количество ионов каждого химического элемента до и после процесса: оно не изменилось, следовательно, знак à заменяем на «=». Составим уравнение диссоциации первого вещества из класса кислот (рабочий исток). Далее – уравнения диссоциации оснований и солей. (Проверка на экране)
Ребята, попробуйте выделить некоторую закономерность в процессах диссоциации кислот, оснований и солей. Начнем с кислот: что общего в этих примерах? – то, что образуются ионы водорода. Уточним – катионы водорода. Попробуйте закончить определение кислоты как электролита…. допишите нужные слова.
КАК доказать, что в растворах кислот именно ионы водорода – единственно возможные катионы, а в растворах щелочей – гидроксид – ионы? Дети предлагают варианты ответов. Правильным будет та гипотеза, которую можно проверить экспериментально.
Воспользуемся индикаторами, которые способны изменять свой цвет в присутствии этих ионов. Делаем вывод, что одинаковое поведение индикаторов в растворах разных кислот и щелочей доказывает наличие в их растворах одинаковых ионов. В кислотах – катионы водорода, в щелочах – растворимых основаниях – гидроксид анионы.
5. Закрепление
Упражнения в составлении уравнений электролитической диссоциации и взаимопроверка (рабочий листок). Учащиеся проверяют друг у друга ответы, сравнивают со своими вариантами, обсуждают результаты.
6. Рефлексия.
Что было новым сегодня на уроке? Какие формы работы вы использовали сегодня на уроке? Для чего необходимы ионные уравнения? Какой шаг будет следующим?
Проверка и оценивание ЗУНКов: Работа учащихся на каждом этапе урока: с индивидуальными карточками-заданиями, выдвижение и обсуждение гипотез.
Рефлексия деятельности на уроке: Ребятам предлагается оценить свое отношение к изученному материалу, высказать свою точку зрения, свое состояние на уроке.
Домашнее задание
§35 до слов «В растворах электролитов наряду с ионами присутствуют…» (повторить). §36 кроме 4, 5, 6 положений
Обязательная часть: Задание Б на карточке №1.
Дополнительная часть: упражнение 4, 5 стр. 203