| Сабақтың барысы:
| Бір түрлі еріткіште әртүрлі электролиттер әртүрлі диссоциацияланады, сондықтан диссоциациялану дәрежесі қабылданған. α = 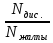 ∙ ∙ Nдис. - диссоциацияланған молекулалар саны, Nжалпы - молекулалардың жалпы саны. Диссоциациялану дәрежесінің изотондық коэффициентпен байланысы: α = 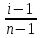 ∙ ∙ n- еріген иондар саны. |
| Күшті электролиттер (α =1 ) Күшті электролиттер толық диссоциацияланған болып есептеледі. Заряды қарама-қарсы иондар көп болған соң, олар бір-біріне тартылады. Әрбір гидраттанған ионның жанында заряды қарама-қарсы иондар орналасады. Иондық атмосфера түзіледі. Еріген заттың концентрациясы көбейген сайын иондық атмосфера ұлғайып, қозғалысқа кедергі жасайды. Сондықтан тәжірибе арқылы анықталған концентрация активтілік деп аталады: а = γ . с γ - активтліік коэффициенті, с - концентрация. |
| Күшті электролиттер: (α=1 немесе α =100%). Негіздер: LіOH, NaOH, KOH, CsOH, RbOH, Ba(OH)2, Sr(OH)2. Қышқылдар: H2SO4, HNO3, HСl, HВr, HІ, HClO4, HMnO4 және барлық дерлік тұздар. | Әлсіз электролиттер: (α 2O, органикалық қышқылдар: бензой және сірке  қышқылдары, бейорганикалық қышқылдар: HCN, H2S, H2CO3, HNO2, H2SіO3, негіздер: NH4OH, барлық нашар еритін негіздер, кейбір тұздар: Hg2Cl2, Fe(CNS)3, Pb(CH3COO)2. қышқылдары, бейорганикалық қышқылдар: HCN, H2S, H2CO3, HNO2, H2SіO3, негіздер: NH4OH, барлық нашар еритін негіздер, кейбір тұздар: Hg2Cl2, Fe(CNS)3, Pb(CH3COO)2. | | Диссоциация константасы Әлсіз электролиттің диссоциациясы: АВ ↔ А+ + В - тепе-теңдік болғанда әсер етуші массалар заңына бағынады, сонда: Кдисс. = 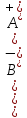 ∙ ∙ Осы тепе-теңдік константасы диссоциация константасы деп аталады. | | Оствальдтың сұйылту заңы: әлсіз электролиттің диссоциациялану дәрежесі ерітіндінің молярлық концентрациясының квадраттық түбіріне кері пропорционал. | | Судың электролиттік диссоциациясы: 2Н2О ↔ (Н3O)+ + ОН-.
| Судың диссоциациялану константасы: К=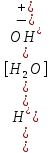 . . | | Судың иондық көбейтіндісі: Кw=[H+][OH-]=10-14. | Сутектік көрсеткіш: рН = - lg [H+] рН − орта қышқыл; рН = 7 − орта нейтрал; рН 7 − орта сілтілі. | Көп қолданылатын индикаторлар | Индикаторлар | Орта | рН | Индикатордың түсі | | Фенолфталеин | Негіздік Қышқылдық | рН7 рН | Қызыл Түссіз | | Лакмус | Негіздік Қышқылдық | рН8 рН | Көк Қызыл | | Метилоранж | Негіздік Қышқылдық | рН7 рН | Сары Қызыл |
Иондық және ковалентті полюсті байланысты қосылыстар ерігенде түзілген иондар судың дипольді молекулаларымен әрекеттесіп, гидраттанған иондар түзеді, яғни диссоциация процесі жүреді. Әрі қарай диссоциация процесінің қайтымды екені, иондарға ыдырау - иондану, ал кері процесс - молекула түзілу деп аталады. Ерітіндіде иондар су молекуласымен байланысқан, яғни гидраттанған күйде болады. Бірден мынадай қорытынды шығаруға болады, гидраттанған мыс ионының кристалдық мыс (II) сульфатындағы мыс айырмашылығы бар. Әрі қарай қышқылдардағы коваленттік байланыстың, оларды суда еріткенде ионды байланысқа айналу механизмі қаралады және сутектің гидраттанған ионы: Н++Н2О = Н3О+ оксоний ионы туралы түсінік енгізіледі. Оксоний ионын гидраттанған протон түрінде қарау керек, осыған байланысты кейінгі жаттығуларда қышқылдардың диссоциациялану теңдеуін жазу әдісіндегі (Н3О орнына Н+) ерекшелік түсіндіріледі, себебі ерітіндіде сутек ионы ғана емес, барлық иондар гидраттанады. Сондықтан иондармен байланысқан су молекуласы реакция теңдеуіне есепке алынбайды. Бұны түсіндіру үшін қышқылдардың оксоний ионын түзе жүретін диссоциация теңдеуін және қысқартылған түрін жазып көрсетеміз: HCl + H2O = H3O+ + Cl- H2SO4 + 2H2O = 2H3O+ + SO42- HNO3 + H2O = H3O+ + NO3- немесе
HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3- Бұдан кейін электролиттік диссоциация теңдеуі қалай жазылатынын және оқылатынын күкірт қышқылының, кальций гидроксидінің, алюминий сульфитінің мысалында түсіндіріледі. Электролиттік диссоциация теңдеуінің жүйеленген жалпы формуласы жазылады: КА = К+ + А- КА – диссоциацияланбаған электролит молекуласы, К+ катион, А- - анион.
|
| Сабақты бекіту: 1. Тұздар, негіздер және қышқылдар сулы ерітінділерінде (балқымаларында) иондарға ыдырайды:
CuCl2= Cu2+ + 2Cl- NaOH = Na+ +Cl- HCl = H+ + Cl- 2.Ерітіндіде түзілген иондар судың полюсті молекуласының әсерінен гидраттанады және бір- бірінен ажырайды. Бұл процесс иондану деп аталады. 3. Иондану процесімен бір мезгілде кері процесс молекула түзілу жүреді. Иодану мен молекула түзілу қайтымды диссоциация процесінің екі жағы:
HCl↔H+ + Cl- (HCl + H2O) ↔ H3O+ + Cl-
4. Еріген заттың оң зарядтарының саны мен теріс зарядтарының саны тең болғандықтан, жалпы электр бейтарап болады. Эксперименттік есептерді шығару барысында, қосымша пысықтау сұрақтарының көмегімен оқушылардың білім деңгейін анықтауға болады. 1. Электролиттік диссоциация теориясының мәнін айтып беріңдер. 2. Тұздардың, негіздердің және қышқылдардың суда ерігенде иондарға диссоциацияланатынын қалай дәлелдеуге болады? 3. Аз мөлшерде тұз алып, суда және этанолда еріткенде алынған ерітінділердің электрөткізгіштігі қалай болады?
|
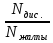 ∙
∙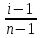 ∙
∙  қышқылдары, бейорганикалық қышқылдар: HCN, H2S, H2CO3, HNO2, H2SіO3, негіздер: NH4OH, барлық нашар еритін негіздер, кейбір тұздар: Hg2Cl2, Fe(CNS)3, Pb(CH3COO)2.
қышқылдары, бейорганикалық қышқылдар: HCN, H2S, H2CO3, HNO2, H2SіO3, негіздер: NH4OH, барлық нашар еритін негіздер, кейбір тұздар: Hg2Cl2, Fe(CNS)3, Pb(CH3COO)2.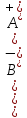 ∙
∙ 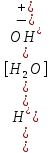 .
.















