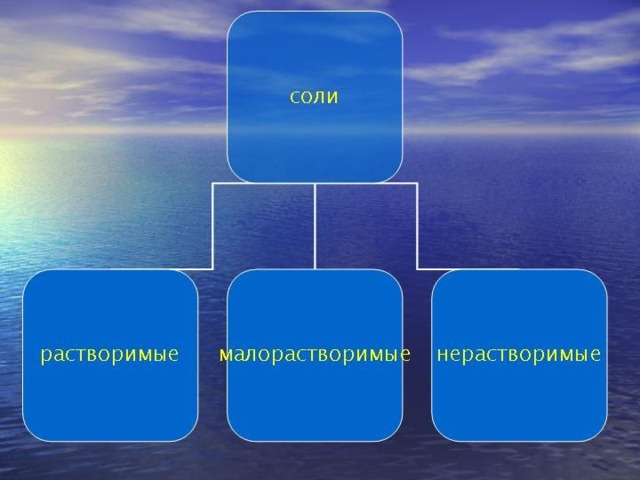
Презентация познакомит с открытием соли, типами солей и тд.
Открытие соли и начало ее употребления было эпохой такого же значения, как знакомство человека с земледелием. Почти одновременно с добычей соли люди научились собирать зерна, засеивать участки земли и собирать первый урожай.
И хотя хлебные зерна содержат мало поваренной соли, не то что мясо и кровь животных, земледелие продолжало развиваться. Следовательно, человек нашел способ удовлетворять солевой голод, который не ощущался при мясном питании. Человек научился добывать соль.
С золой растений, которой первоначально посыпались лепешки и мясо, человек, кроме полезных солей, поглощал гораздо большее количество вредных веществ. Понадобились тысячелетия, чтобы человек, уже знакомый с огнем, научился его добывать из кремня или трением одного куска дерева о другой. И много времени прошло, пока люди научились добывать соль.
Десятки тысячелетий протекли с тех пор, как человек научился делать орудия из камня, до периода, когда он стал пользоваться металлами, научился плавить руду и ковать бронзовое ору














![Интересные факты. Обычная пищевая соль в больших количествах является ядом — летальная доза в 100 раз превышает суточную норму потребления и составляет 3 грамма на 1 килограмм массы тела, то есть для человека весом 80 кг смертельной дозой является четверть килограммовой пачки. Продаваемая в магазинах соль состоит из NaCl примерно на 97 %, остальная доля приходится на различные примеси. Чаще всего добавляют йодиды и карбонаты, в последние годы всё чаще добавляют фториды. Добавка фторидов используется для профилактики зубных заболеваний. С 1950-х годов добавлять фторид в соль стали в Швейцарии, и благодаря положительным результатам в борьбе с кариесом в 1980-х годах фторид стали добавлять в соль во Франции и в Германии. До 60 % продаваемой соли в Германии и до 80 % в Швейцарии содержит фториды. [ источник не указан 265 дней ] Иногда в поваренную соль добавляют другие вспомогательные вещества, например ферроцианид калия (E536 в европейской системе кодирования пищевых добавок ; неядовитая комплексная соль) в качестве антислёживающего агента.](https://fsd.kopilkaurokov.ru/uploads/user_file_57c5378e8011e/img15.jpg)
![Известно, что, уходя из таежного приюта, для случайных путников охотники непременно оставляют спички и соль. [1] На Руси издавна было принято в Страстной четверг готовить так называемую «четверговую соль» — крупную соль смешивали с квасной гущей или мякишем ржаного хлеба и перекаливали на сковороде, после чего толкли в ступе . Четверговую соль употребляли с пасхальными яйцами и некоторыми другими блюдами. [8] Гадания посредством соли известны с древнейших времён [ источник не указан 23 дня ] и именуются аломантия . В геральдике соль изображена в гласных гербах русских городов Бахмута , Солигалича , Соликамска , Сольвычегодска . Герб Бахмута — химический знак соли Герб Бахмута В.Кене — три кристалла соли Герб Соликамска - соляной колодец Герб Солигалича — три ступки соли](https://fsd.kopilkaurokov.ru/uploads/user_file_57c5378e8011e/img16.jpg)






























