Тема урока: «Растворы. Растворимость веществ в воде.» 8-й класс .
Тип урока: урок сообщения новых знаний. Это первый урок в теме « Растворы. Вода»
Цель урока: расширить знания о процессе растворения и растворах.
Задачи урока:
Развивающие:
- интерес к химии, мышление.
- экспериментальное исследование и творческие навыки,
- формирование умений учащихся работать с таблицей растворимости.
Обучающие:
- познакомить с растворением как физико-химическим процессом,
- научить давать классификацию растворов по признаку растворимости и выяснять причины различной растворимости веществ.
- сформировать понятия: раствор, растворитель, растворение.
Воспитательные:
- воспитывать культуру общения,
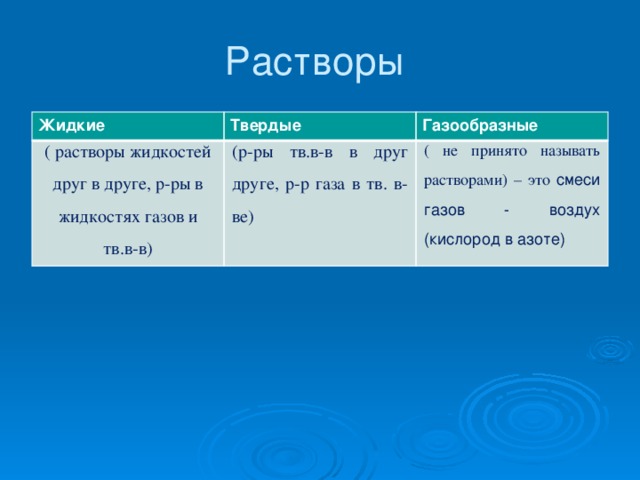
Основные понятия. Раствор, растворитель, растворимость, насыщенный и ненасыщенный растворы, гидраты.
Оборудование: вода, карбонат натрия, сульфат меди , концентрированная серная кислота, мел, сахар, медный купорос, спирт, раздаточный материал с приложениями
Демонстрации: Растворение в воде карбоната натрия, сульфата меди; растворение в воде сахара, мела; растворение серной кислоты в воде. Растворение в воде и спирте медного купороса.
Методы и методические приёмы:
- словесный (беседа, рассказ учителя),
- наглядный (таблица растворимости)
- демонстрация опытов;
- работа с учебником;
- Планируемые результаты урока:
В результате проведенного урока учащиеся должны усваивоить, что
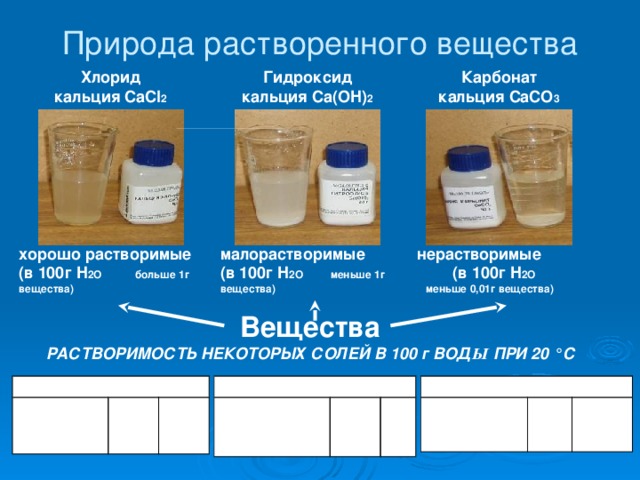
- растворимость – способность вещества образовывать с другими веществами однородные системы – растворы;
- растворимость веществ может быть различной и зависит от природы растворенного вещества, природы растворителя, температуры;
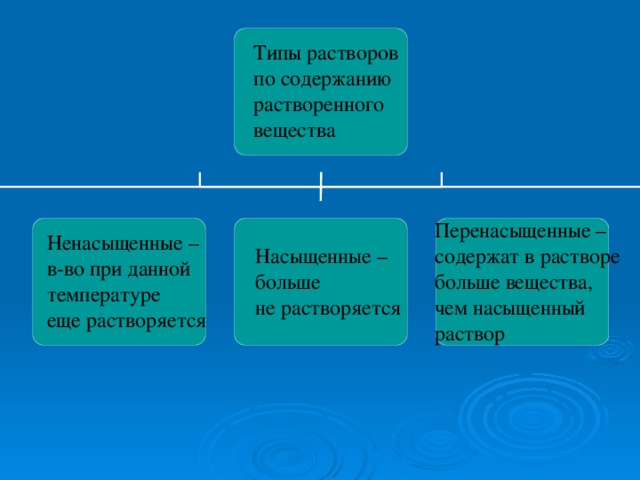
- растворы могут быть ненасыщенными, насыщенными, пересыщенными.
При изучении процессов растворимости различных веществ учащиеся должны:
- определять факторы, влияющие на растворимость веществ;
- выявлять, что растворимость веществ зависит от природы растворенного вещества и растворителя;
- устанавливать связь растворимости твердых веществ с температурой и массой растворенного вещества.
Ход урока:
Деятельность учителя
Деятельность учащихся
Примечание
1 этап. Организационный
1.Приветствие:
- Здравствуйте, ребята! Присаживайтесь. Сегодня на уроке будет множество вопросов, на которые мы должны дать ответ. Надеюсь, что мы все с этим справимся.
- Проверим нашу готовность к уроку. Проверьте на столах тетради, учебники, лист успешности, ручки. - Из курса природоведения и физики вы уже знаете, что в природе есть вещество, без которого нет жизни на земле. Кто скажет, что это за вещество? Почему вы так считаете? Каким уникальным свойством оно обладает?
2. Организация рабочих мест:
- Открываем тетради и записываем сегодняшнее число, и тему урока с доски.
3. Оглашение цели урока учащимся:
- Сегодня мы познакомимся с понятием растворение и растворами как физико-химическими системами.
4. Необходимый инструктаж:
Мы будем с вами работать сегодня вот с такими картами (прил. 1), и давайте оценим наше эмоциональное состояние в начале урока, а потом - в конце нашей работы. Нарисуйте один из значков - солнышко, ёлочка, тучка – в вашей карте.
Учащиеся приветствуют учителя
Учащиеся работают в тетрадях
Учащиеся знакомятся с целью урока
Ученики работают с картами.
1. Настрой учащихся на учебную деятельность
2.
2 этап: Проверка знаний (мотивационный момент)
1.Беседа учителя:
-Верно. Без воды невозможна жизнь, без ее участия невозможны многие химические реакции.
Одной из ее главных особенностей является способность растворять различные вещества: и газы, и жидкости, и, конечно, твёрдые вещества.
- Как я уже говорила, мы сегодня поговорим о водных растворах, узнаем, что происходит при растворении с веществами, какими новыми свойствами обладают растворы по сравнению с чистыми веществами, их образующими.
Учащиеся отвечают на вопросы.
Определяются имеющиеся знания учащихся
3 этап. Подготовка учащихся к сознательному усвоению нового материала.
1.Беседа с учащимися:
- С растворами вы встречаетесь в жизни постоянно.
Вопрос: А какие же вам известны растворы? Какова роль растворов в природе и технике?
2.Сообщение учителя:
В природе и технике растворы имеют огромное значение:
1) Растения усваивают вещества в виде растворов;
2) Усвоение пищи связано с переводом питательных веществ в раствор;
3) Все природные воды являются растворами;
4) Растворами являются важнейшие физиологические жидкости – кровь, лимфа и т.д.
5) Многие технологические процессы в химической и других отраслях промышленности, например получение соды, удобрений, кислот, металлов, бумаги, протекают в растворах.
6) На лабораторных занятиях мы тоже работаем в основном с растворами.
Таким образом, значение растворов велико.
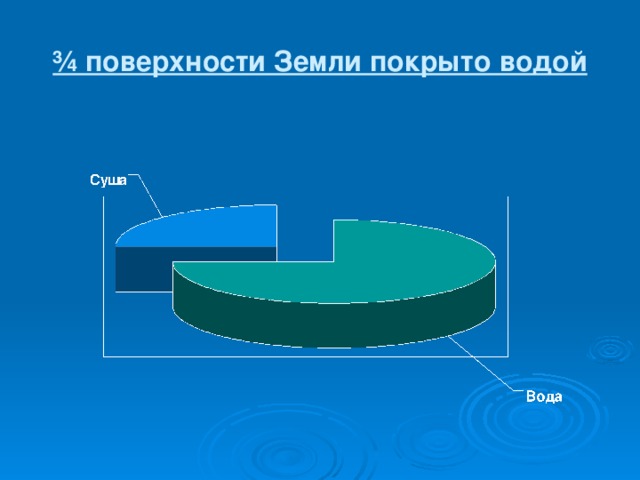
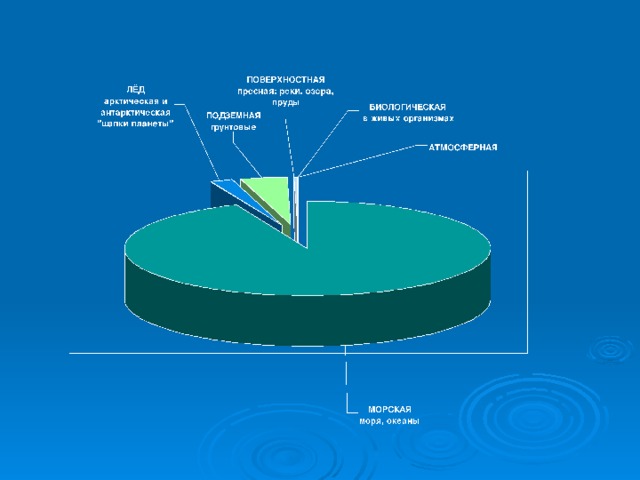
Особую роль на нашей планете играет вода. Из всех жидкостей вода служит наилучшим растворителем, обладает наибольшей теплоёмкостью. Вода входит в состав клеток и тканей любого животного и растения.
Вода является единственным веществом, существующим в природе в 3 агрегатных состояниях. В каких?