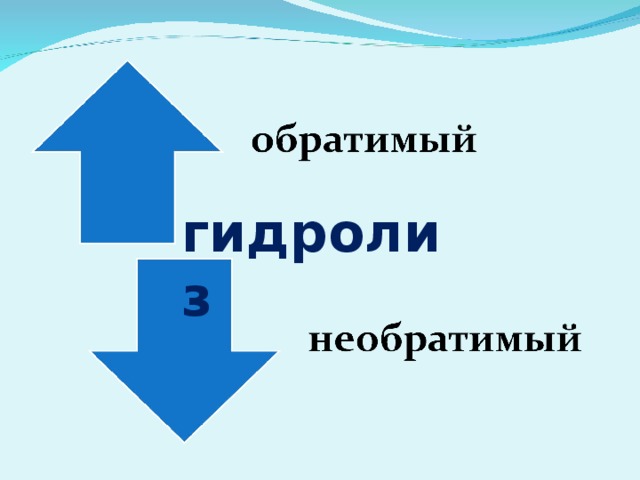
В повседневной жизни мы постоянно сталкиваемся с явлением гидролиза – при стирке белья, мытье посуды, умывании мылом. Даже процессы пищеварения, в частности, расщепление жиров, протекают благодаря гидролизу.Вы знаете, что, согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация по химии на тему "Гидролиз"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«презентация по химии на тему "Гидролиз" »
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
1990 руб.
2840 руб.
1930 руб.
2760 руб.
1930 руб.
2760 руб.
2200 руб.
3140 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства



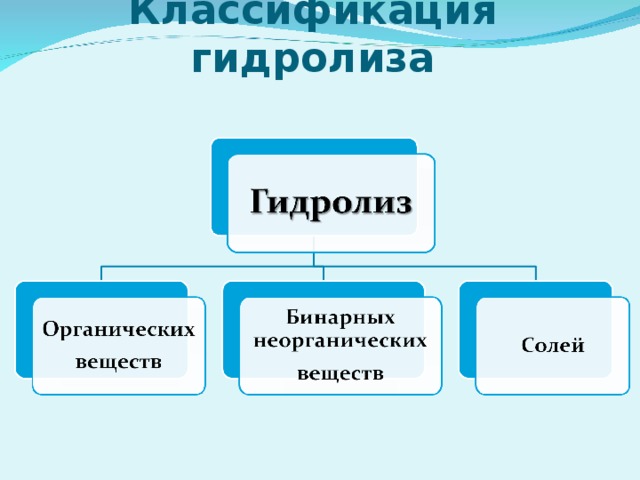
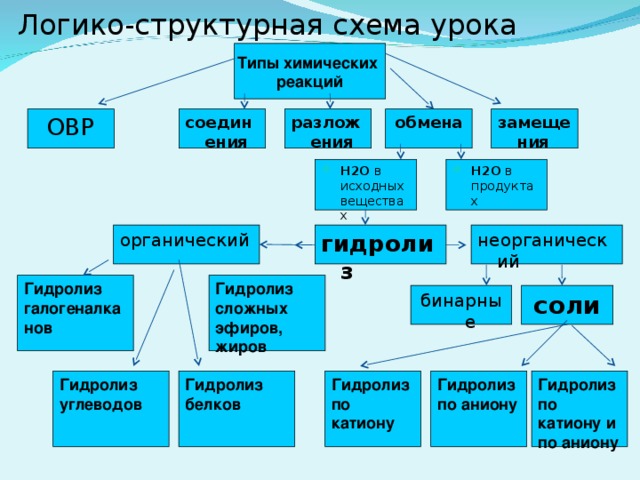


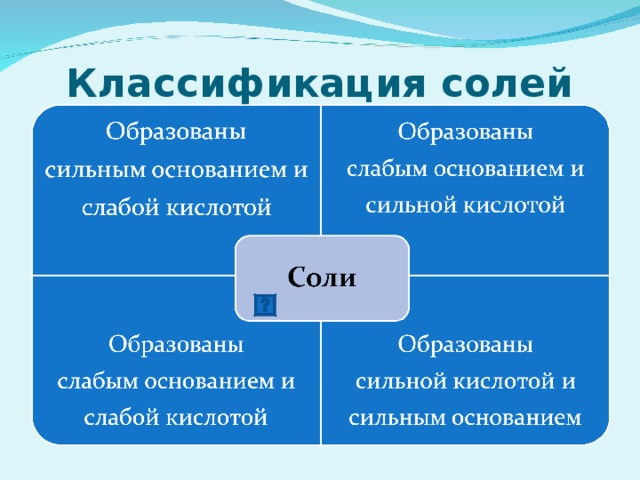



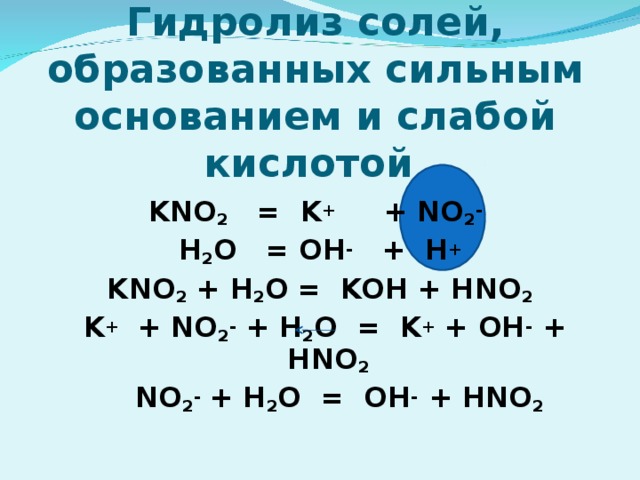
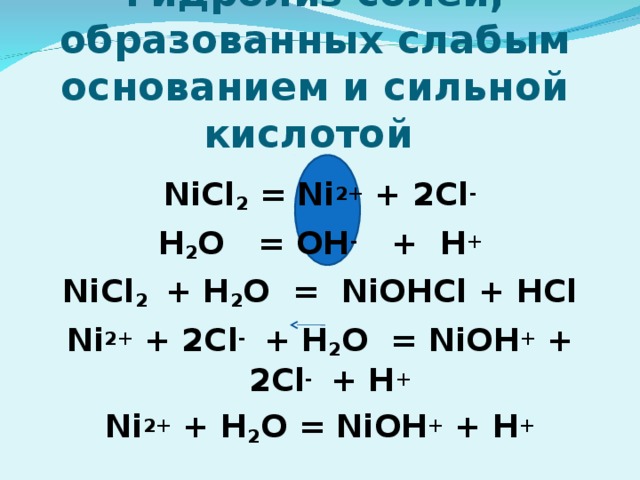
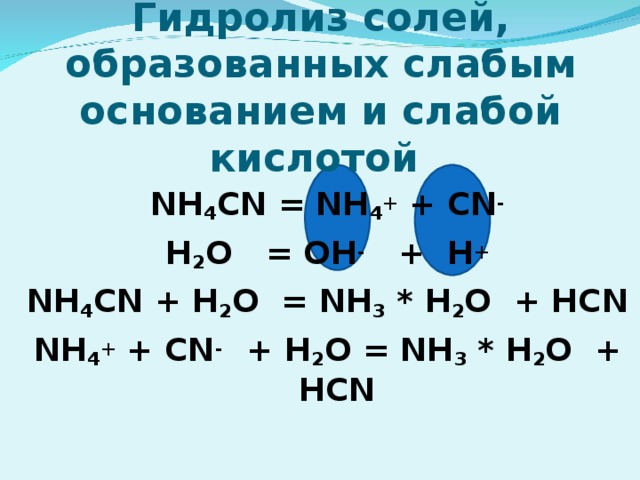
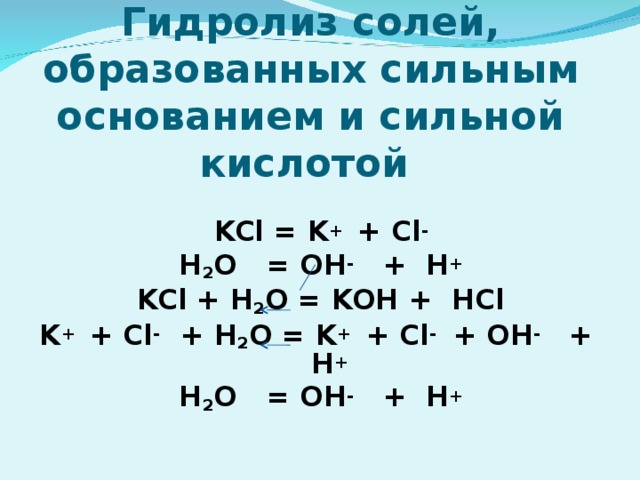
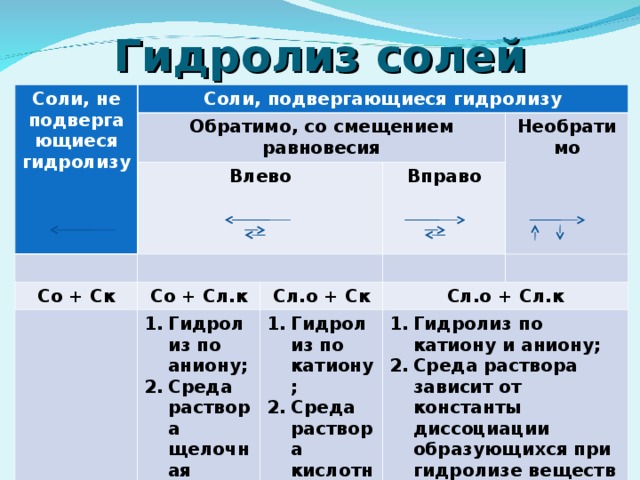 7) Гидролиз по катиону; Среда раствора кислотная (рН" width="640"
7) Гидролиз по катиону; Среда раствора кислотная (рН" width="640"