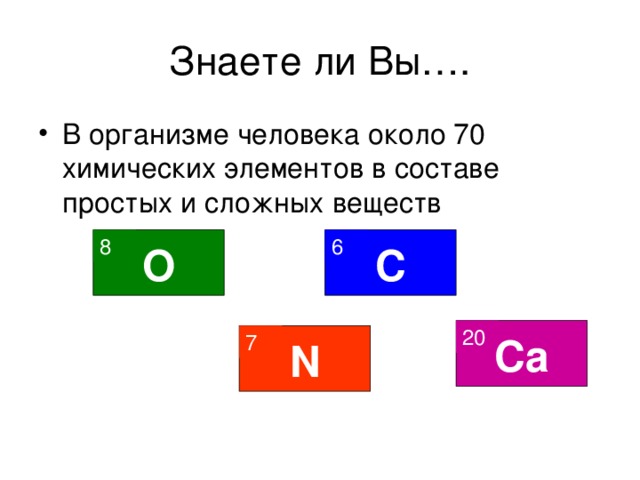
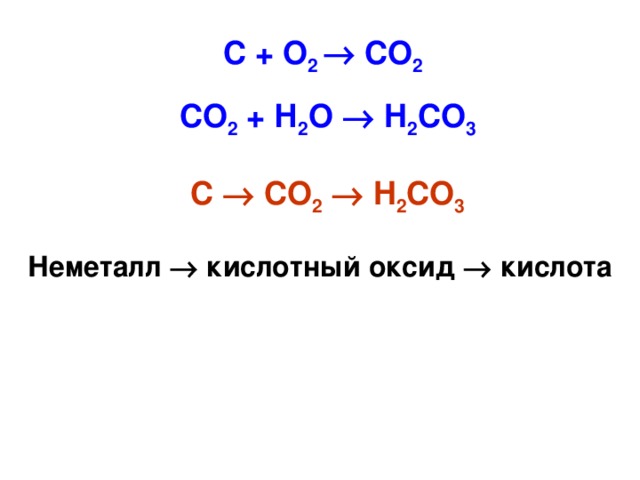
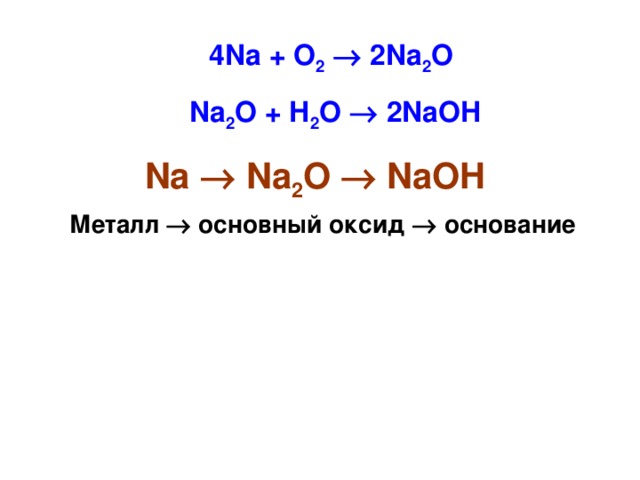
Классификация химических элементов Знаете ли Вы…. В 1860 году были известны 60 химических элементов, на сегодняшний день открыты 118 элементов 8
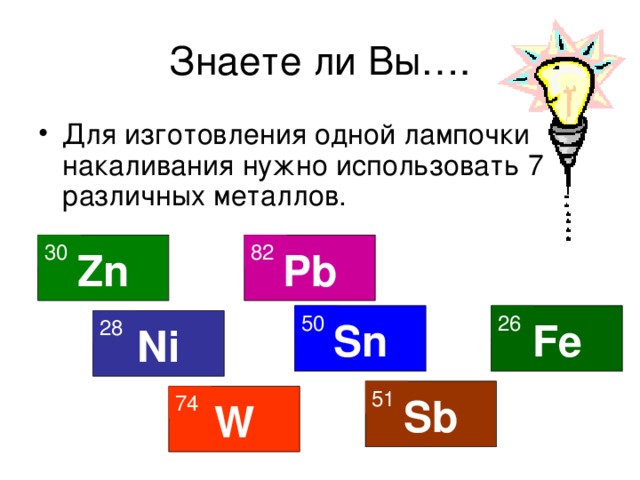
Знаете ли Вы…. По мнению средневековых алхимиков природа создала 7 металлов по числу планет. 17
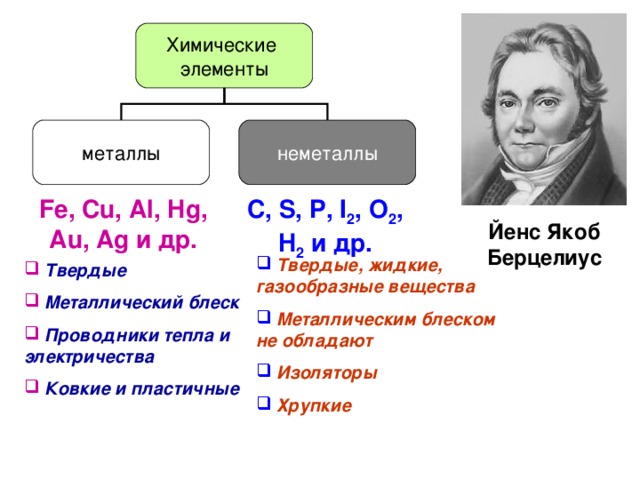
Знаете ли Вы…. Во время I мировой войны применение ядовитого желто-зеленого газа привело к гибели многих людей, а благодаря посуде, из которой ели пищу, офицеры армии Македонского избежали кишечных болезней. Йенс Якоб Берцелиус
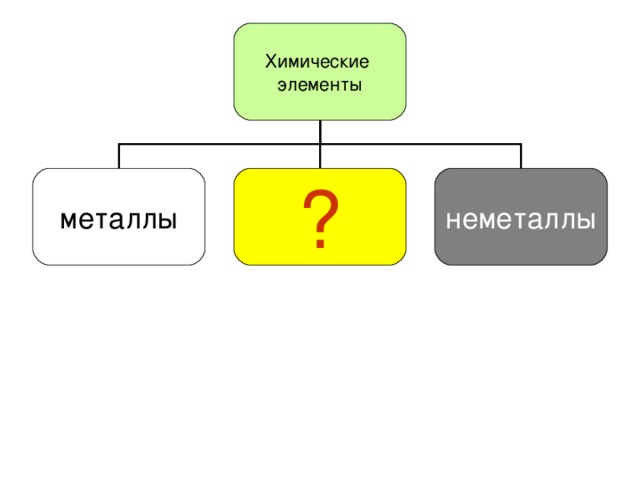
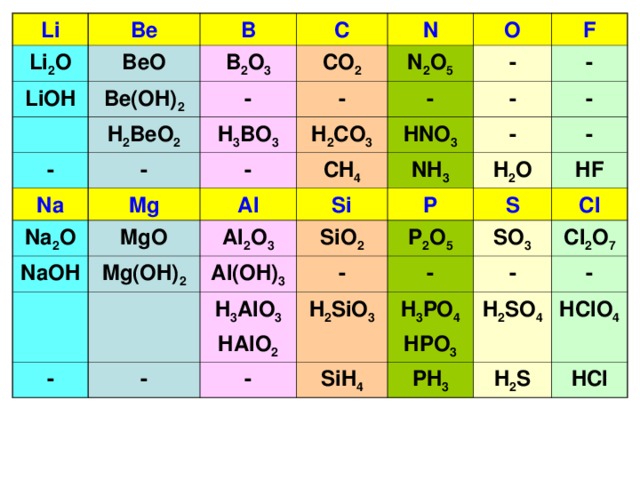
Химические элементы
Твердые Металлический блеск Проводники тепла и электричества Ковкие и пластичные
Твердые, жидкие, газообразные вещества Металлическим блеском не обладают Изоляторы Хрупкие
В 1844 году Г.Дэви и М.Фарадей сожгли в запаянных колбах равные пропорции алмаза, графита, угля. В результате опыта получили равные объемы газов.
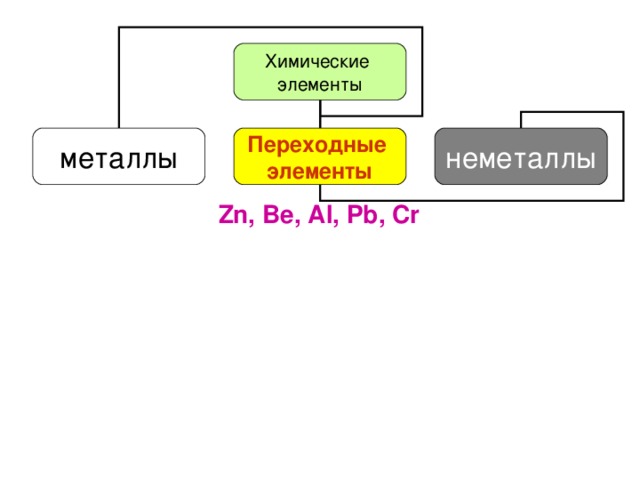
Химические элементы металлы неметаллы
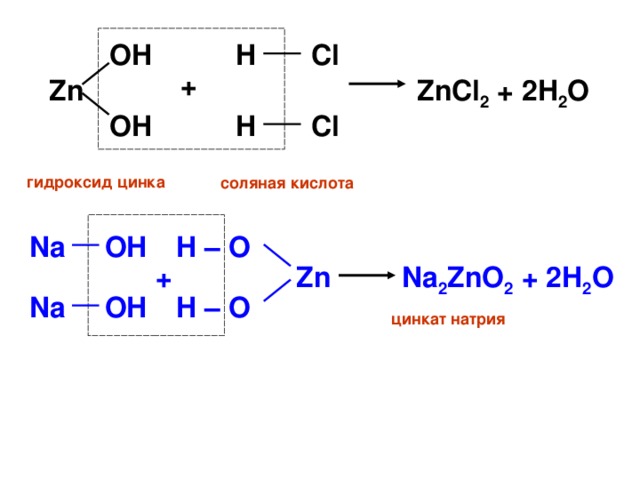
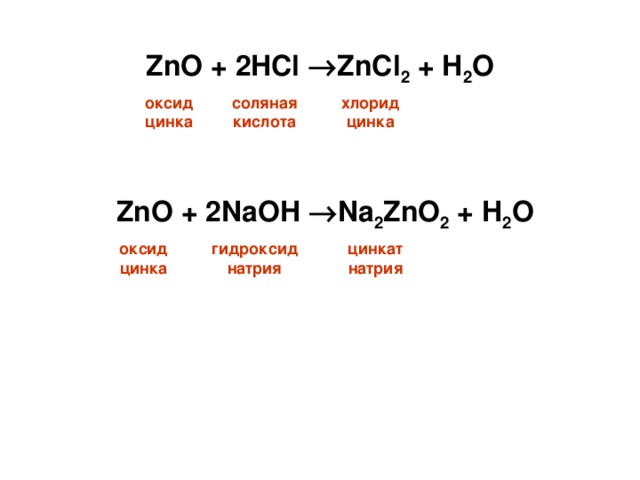
оксид цинка соляная кислота хлорид цинка
оксид цинка гидроксиднатрия цинкат натрия
Оксиды и гидроксиды, которые способны реагировать и с кислотами и со щелочами, называют амфотерными (от. греч. «амфотерос» - оба, тот и другой)
Химические элементы металлы
Переходные элементы неметаллы
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация к уроку химии в 8 классе "Классификация химических элементов"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация к уроку химии в 8 классе "Классификация химических элементов" »
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
1770 руб.
2530 руб.
1930 руб.
2760 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства