Тема урока. «Химическое равновесие, условия его смещения»
Цель урока: актуализировать, расширить и углубить знания учащихся о необратимых и обратимых реакциях; дать понятие химического равновесия и условиях его смещения.
- систематизировать знания классификации химических реакций по направлению химических реакций (необратимые и обратимые реакции);
- дать представление о химическом равновесии, равновесных концентрациях веществ, (константе химического равновесия), факторах, влияющих на смещение равновесия;
- формировать умения применять принцип Ле Шателье на конкретных примерах, - формировать логическое мышление;- развивать умения устанавливать причинно- следственные связи .
Ход урока.
1.Организационный момент.
2.Подготовка к восприятию нового материала.
Сегодня мы продолжим изучение химической кинетики-раздела физической химии, которая изучает закономерности протекания химических реакций. Давайте вспомним некоторые моменты прошедших уроков.
? Что понимают под скоростью химической реакции?
? Какие факторы влияют на скорость химических реакций?
? Что называется катализатором?
? Какой основной закон химической кинетики вы знаете?
? Что вы знаете об необратимых и обратимых реакциях?
3.Изучение нового материала
(сопровождается показом кадров из презентации)
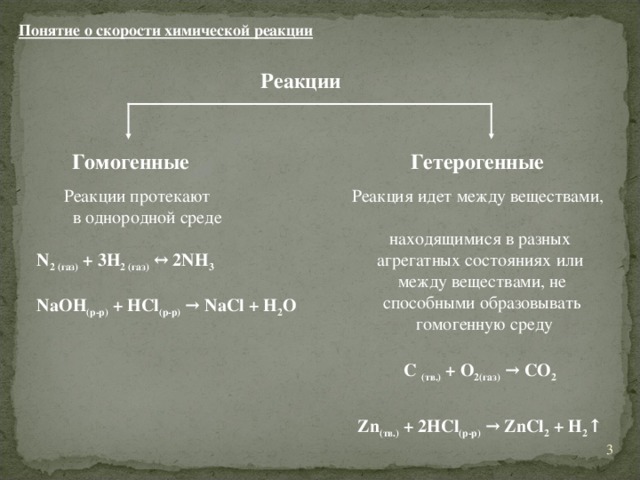
Большинство химических реакций, протекающих в природе и технике, являются обратимыми. В органической химии об этом говорят термины-антонимы: гидрирование-дегидрирование, гидратация-дегидратация. Строго говоря, необратимых реакций нет, и любой из процессов, рассмотренный как необратимый, может быть превращен в обратимый в условиях замкнутой системы. (пример с разложением известняка). Поэтому уместно запомнить другое определение обратимой реакции.
Обратимая реакция- это система, состоящая из прямой и обратной реакций.
- + bB → dD + fF –прямая реакция, aA + bB ← dD + fF-обратная реакция, тогда aA + bB ↔ dD + fF-обратимая реакция (в общем виде).
? Как вы думаете, что такое химическое равновесие?
В обратимой системе рано или поздно будет достигнуто состояние, при котором скорости прямой и обратной реакций стану равными.
Химическое равновесие – это такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие является динамичным (подвижным), так как при его наступлении реакция не прекращается
При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями и обозначаются символами: [А],[В],[],[].
Для количественного определения полноты протекания химической реакции (выхода продуктов реакции) была введена константа равновесия реакции Кр, выведенная на основе закона действующих масс.
? Для общего уравнения обратимой реакции напишите кинетические уравнения для прямой и обратной реакций. kпр.* [A]a * [B]b, kобр.* [D]d * [F]f
Прировняв эти уравнения и выразив отношение констант скоростей мы получим выражение константы химического равновесия:
[D]d * [F]f
- = [A]a * [B]b
? Можно ли по величине Кр (больше-меньше единицы) узнать что-либо об обратимой химической реакции?
Если Кр >1, то выход продуктов реакции большой и преобладает прямая реакция.
Если Кр <1, то выход продуктов реакции мал и преобладает обратная реакция.
Значение Кр зависит от природы реагирующих веществ и температуры.
Значения Кр находят путем расчета или на основании экспериментальных данных.
При 4250С для реакции H2 + I2 ↔ 2HI, Кр=54,441.
? Что показывает данная цифра?
? Запишите выражение Кр для данного уравнения реакции.
Состояние химического равновесия при неизменных внешних условиях сохраняется сколько угодно долго. На химическом производстве необходимо, чтобы образовывался продукт реакции, то есть равновесие сместилось в сторону прямой реакции.
На протяжении почти сто лет развивалось учение о химическом равновесии, начиная с французского химика К. Бертолле в 1801-1803гг., затем были работы французов Малагути и Девиля, русских химиков Н.Н. Бекетова и А.Л. Потылицына и многих других ученых.
Французский химик Анри Ле Шателье в1884 г. вывел правило смещения химического равновесия, которое известно под названием принцип Ле Шателье или «правило наоборот».
? В чем смысл принципа Ле Шателье? (Чем больше действие, тем сильнее противодействие).
? Попытайтесь сформулировать этот принцип?
? Как вы думаете, какие факторы(условия) влияют на смещение химического равновесия?
Если на систему, находящуюся в равновесии оказывается внешнее воздействие (изменяется температура, давление, концентрация), то равновесие смещается в сторону той реакции, которая ослабляет это воздействие.
Катализатор не влияет на смещение равновесия, так как одинаково ускоряет как прямую, так и обратную реакции, с помощью катализатора можно ускорить момент наступления химического равновесия.
Условия, влияющие на смещение химического равновесия.
I условие-влияние температуры (Т).
Учитываем тепловой эффект прямой реакции: (+Q) или(- Q)!!!
? Что такое тепловой эффект реакции?
? Какие реакции по тепловому эффекту вы знаете?
Используем шаблон, исходя из «правила наоборот»:
Если Т повышаем , то система понижает (в сторону эндотермической реакции);
Если Т понижаем, то система повышает (в сторон экзотермической реакции).
II условие-влияние давления (р).
? Что показывают коэффициенты для газов в уравнении химической реакции?
Учитываем сумму объемов для газов до и после реакции!!!
Используем шаблон, исходя из «правила наоборот»:
Если р повышаем, то система понижает (в сторону уменьшения объемов);
Если р понижаем, то система повышает (в сторону увеличения объемов);
Изменение р не влияет на равновесие если сумма объемов газов не меняется.
III условие-влияние концентраций (С).
Учитываем направление реакции образования- разложения конкретного вещества!!!
НЕ ПУТАТЬ ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ВЕЩЕСТВО! Используем шаблон:
Если СА повышаем, то система понижает (в сторону разложения вещества А);
Если СВ понижаем, то система повышает (в сторону образования вещества В).
Принцип Ле Шателье универсален, так как применим не только к чисто химическим процессам на производстве, но и к процессам происходящим в организмах(медицина), в природе(экология), к физико- химическим явлениям (испарение, конденсация, кипение, растворение, кристаллизация и др.).
Каждому ученику вручается карточка-подсказка с шаблонами для работы дома и в школе.
4.Закрепление знаний, умений, навыков.
Рассмотрим на примере синтеза аммиака как применяется принцип Ле Шателье.
Задание 1. Дадим характеристику этой реакции по основным признакам классификации
химических реакций. Работаем устно (фронтальный опрос).
Fe
3Н2 + N2 2NH3 +Q . Это реакция:
- обратимая;
- окислительно-восстановительная;
- соединения-прямая реакция, разложения-обратная реакция;
- экзотермическая- прямая, эндотермическая- обратная;
- каталитическая;
- гомогенная (без катализатора);
- идет с уменьшением объемов-прямая, с увеличением объемов- обратная.
Задание 2. Укажите и объясните как сместится химическое равновесие при
предлагаемых условиях для данной реакции: Т , р Н2 NH3 .
(Вместо слов «повышаем»- «понижаем» используем знаки ( ) - ( ),(→)-вправо,(←)-влево)
Каждый выполняет работу самостоятельно, затем проверяем у доски.
T , c- мa , (в сторону эндотермической реакции) (←)
p , c- мa , (в сторону уменьшения объемов) (→)
CH2 , (в сторону разложения вещества Н2) (→)
CNH3 , c-мa , (в сторону образования вещества NН3) ( →).
Задание 3. (работа в парах)
Даны уравнения реакций:
- 2H2(г.)+ O2(г.) ↔ 2H2O(г.)+ Q;
- CO(г.) + H2O(г.)↔ CO2(г.) + H2(г.) ? Q;
- C(тв.) + CO2(г.)↔2CO(г.) ?Q;
- CaCO3(тв.) ↔CaO(тв.) + CO2(г.)
- 2SO2(г.) + O2(г.) ↔ 2SO3(г.) +Q ;
- 2NH3(г.) ↔ N2(г.) + 3H2(г.)?Q.
Для каких реакций: а) при повышении температуры равновесие сместится вправо;
б) изменение давления не повлияет на химическое равновесие; в) повышение давления и понижение температуры одновременно смещает равновесие в одном направлении? Ответ аргументируйте.
Ответы: а)2,3,4,6; б)2; в)1,5.
5.Подведение итогов урока.
? Какие знания, умения вы получили на сегодняшнем уроке?
Учитель- оценивает работу учеников;
- задает домашнее задание(§16, упр.3,5,6, по желанию -карточки с заданиями)
- благодарит класс за работу.
ПРИЛОЖЕНИЕ.
Карточка-подсказка.
Условия смещения химического равновесия
по принципу Ле Шателье.
I условие-влияние температуры (Т).
Учитываем тепловой эффект прямой реакции: (+Q) или(- Q)!!!
Если Т повышаем , то система понижает (в сторону эндотермической реакции);
Если Т понижаем, то система повышает (в сторон экзотермической реакции).
II условие-влияние давления (р).
Учитываем сумму объемов для газов до и после реакции!!!
(коэффициенты в уравнении химической реакции показывают число объемов для газов)
Если р понижаем, то система повышает (в сторону увеличения объемов);
Если р повышаем, то система понижает (в сторону уменьшения объемов);
Изменение р не влияет на равновесие если сумма объемов газов не меняется.
III условие-влияние концентраций (С).
Учитываем направление реакции образования- разложения конкретного вещества!!!
НЕ ПУТАТЬ ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ВЕЩЕСТВО!
Если СА повышаем, то система понижает (в сторону разложения вещества А);
Если СВ понижаем, то система повышает (в сторону образования вещества В).



![Понятие о скорости химической реакции Скорость гомогенной реакции (υ гомог. ) определяется изменением концентрации одного из веществ в единицу времени ΔC моль [ ] υ гомог. = Δt л · с](https://fsd.kopilkaurokov.ru/uploads/user_file_548f1fcc28ad6/img_user_file_548f1fcc28ad6_4.jpg)


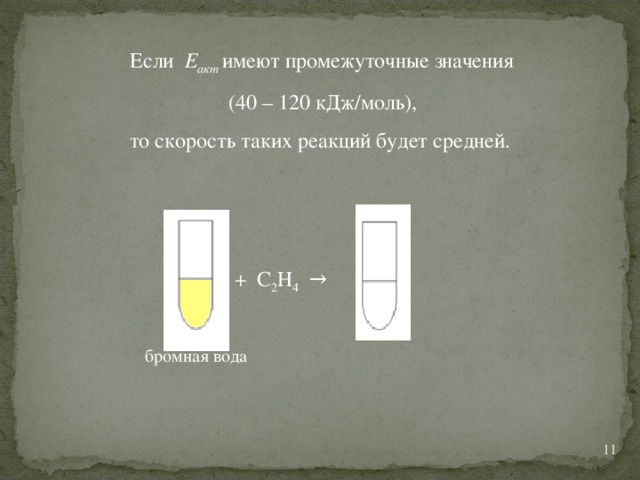
 энергия активации ▪ чем меньше Е акт , тем больше υ; 5" width="640"
энергия активации ▪ чем меньше Е акт , тем больше υ; 5" width="640"
![Если Е акт скорость такой реакции очень большая. FeCl 3 + K 4 [Fe(CN) 6 ] → Fe 4 [Fe(CN) 6 ] 3 берлинская лазурь 5](https://fsd.kopilkaurokov.ru/uploads/user_file_548f1fcc28ad6/img_user_file_548f1fcc28ad6_8.jpg)
 120 кДж/моль, скорость таких реакций очень мала. 4Fe + 2Н 2 О + ЗО 2 →2(Fe 2 O 3 • Н 2 О) ржавление железа 9" width="640"
120 кДж/моль, скорость таких реакций очень мала. 4Fe + 2Н 2 О + ЗО 2 →2(Fe 2 O 3 • Н 2 О) ржавление железа 9" width="640"







 υ ↑. ▪ Катализаторы остаются неизменными по окончании реакции ▪ Ферменты – биологические катализаторы, по природе белки ▪ Ингибиторы – вещества, которые ↓ υ 11" width="640"
υ ↑. ▪ Катализаторы остаются неизменными по окончании реакции ▪ Ферменты – биологические катализаторы, по природе белки ▪ Ингибиторы – вещества, которые ↓ υ 11" width="640"


























