Водород-это первый элемент в периодической системе химических элементов

Рождающий воду
2014 г
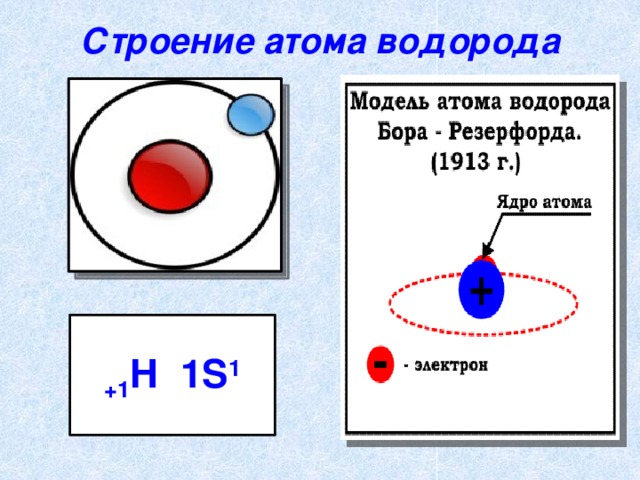
Строение атома водорода
+1 H 1S 1
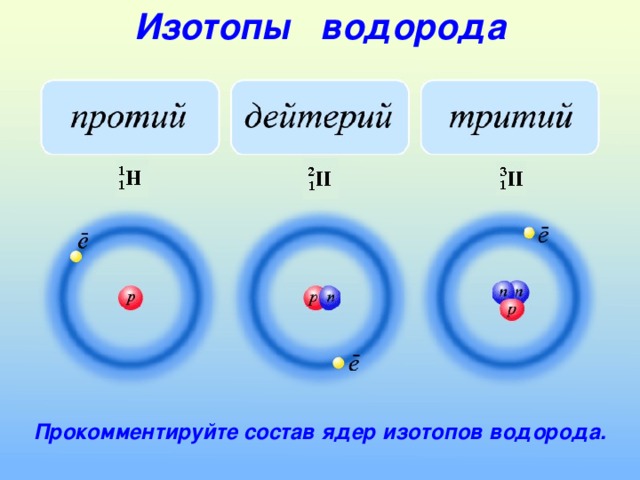
Изотопы водорода
Прокомментируйте состав ядер изотопов водорода.

Водород-окислитель или восстановитель?
Водород расположен в периодической системе в главных подгруппах I и VII групп. Это обусловлено сходством водорода и со щелочными металлами и с галогенами.

Н 2
+
+
-
-2
NaH
Водород обладает окислительно-восстановительной двойственностью. Восстановительные свойства у него выражены сильнее,чем окислительные. Почти всегда его степень окисления + 1, реже -1.
Отдавая электрон,водород проявляет свойства восстановителя.
Принимая электрон,водород проявляет свойства
окислителя.
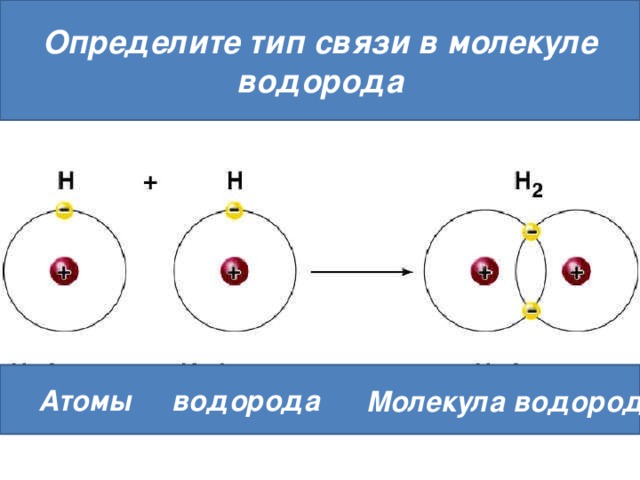
Молекула водорода
Н:Н
Н-Н
Н 2
Определите тип связи в молекуле
водорода
Атомы водорода
Молекула водорода

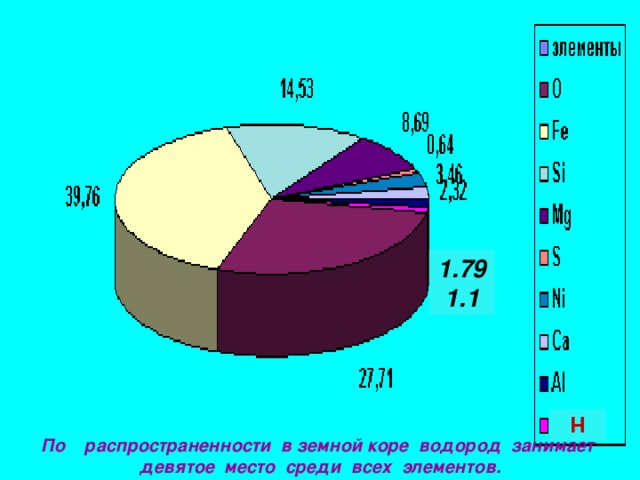
Водород в природе
Это элемент космоса. Он составляет около половины массы Солнца и большинства звезд. Межзвездные пространства и черные дыры нашей Вселенной заполнены водородом. Солнце освещает нашу планету и согревает ее своим теплом благодаря непрерывным взаимопревращениям водорода и гелия.
1.79
1.1
На Земле водород встречается главным образом в виде соединений. Он входит в состав воды. Вода на 11,11% состоит из водорода.
Н
Водород участвует в образовании природного газа, нефти, многих минералов.
На долю водорода приходится около 1% от массы всей земной коры.
Водород входит в состав всех растительных и животных организмов
По распространенности в земной коре водород занимает девятое место среди всех элементов.
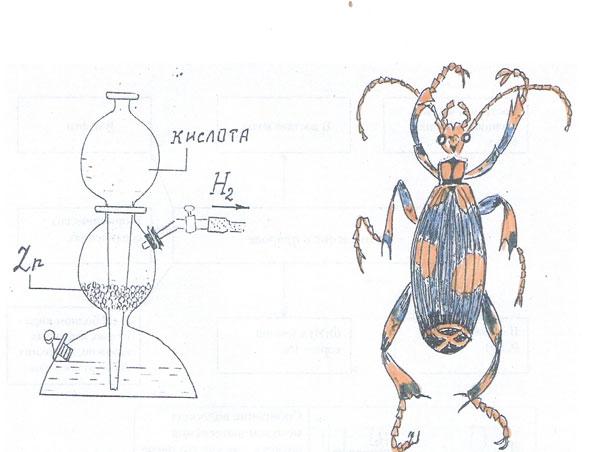
Получение водорода
В лаборатории
В промышленности
Zn+2HCl=ZnCl 2 +H 2
2H 2 O=2H 2 +O 2

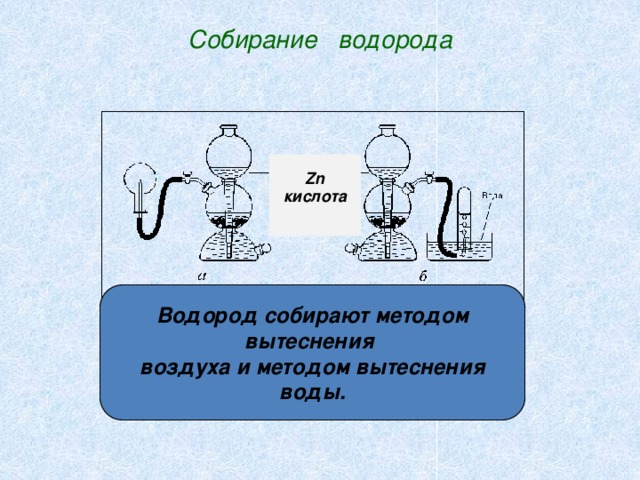
Собирание водорода
кислота
Zn
Водород собирают методом вытеснения
воздуха и методом вытеснения воды.
Физические свойства
Бесцветный газ, не имеющий вкуса и запаха. Самый легкий из всех газов, в 14,5 раза легче воздуха. Малорастворим в воде. Один из самых трудносжижаемых газов. Температура кипения жидкого водорода -252,8 о С.

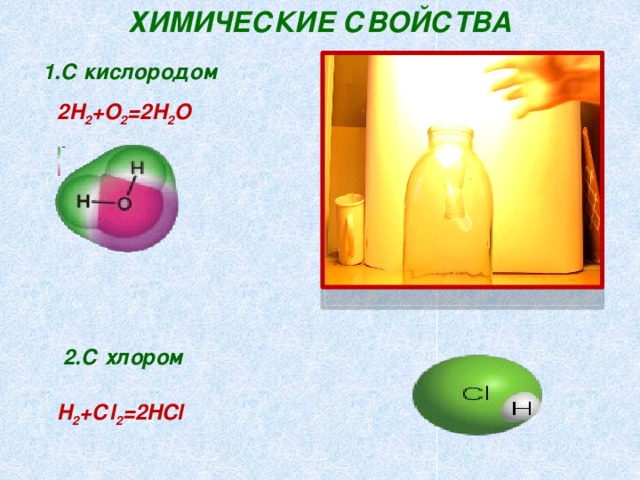
Химические свойства
1.С кислородом
2Н 2 +О 2 =2Н 2 О
2.С хлором
Н 2 +Сl 2 =2HCl

Гремучий газ
.
Смесь двух объемов водорода и одного
объема кислорода называют гремучим газом. Эта смесь взрывоопасна. Взрывчатыми свойствами обладает и смесь водорода с воздухом.
Французский химик Пилар де Розье (18 в) заинтересовался, что будет ,если выдохнуть водород на пламя свечи. Он сделал это. Произошел взрыв! Розье впоследствии писал: «Я думал, что у меня вылетят все зубы с корнями» Помните: водород взрывоопасен!При работе с ним надо быть осторожным!
2Н 2 +О 2 =2Н 2 О
Пилатр де Розье –первый человек , официально поднявшийся в воздух

3.Водород-восстановитель.
H 2 0 + Cu +2 O = Cu 0 + H 2 + O
H 2 0 - 2e - = 2H +
окисляется
Cu +2 + 2e - = Cu 0
восстанавливается
Водород применяют в металлургии
для восстановления некоторых металлов
(вольфрам, молибден и др.)
Оксиды активных металлов водородом не восстанавливаются.

Применение водорода
Водород как топливо будущего
При сгорании водорода выделяется большое количество теплоты, при этом не образуется вредных экологически опасных веществ. Основным продуктом сгорания является вода. Кроме того, запасы водорода неисчерпаемы. Широкое внедрение водорода в энергетику- вопрос недалекого будущего.Главное- найти неэнергоемкий способ его получения из воды.
Водородные мопеды уже есть. Скоро появятся водородные мотоциклы .
Водородный гонщик
Водород-лучшее ракетное топливо
Водород используется в производстве перекиси водорода и химических реагентов
в водородной сварке
в гидрировании растительных масел
Упражнения
По рисунку прокомментируйте
1.Нахождение Н 2 в природе;
2.Физические свойства Н 2 ;
3.Способы получения Н 2 ;
4.Способы собирания Н 2.

1.Охарактеризуйте строение атома водорода.
2. На основании строения атома охарактеризуйте окислительно-восстановительные способности атомов водорода.
3.Назовите соединения:NaH, CaH 2 , AlH 3 .Определите степени окисления элементов в данных соединениях.

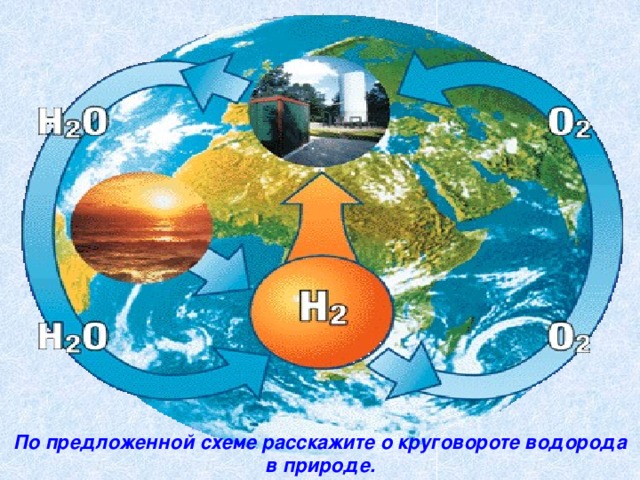
По предложенной схеме расскажите о круговороте водорода в природе.