МБОУ «СОШ № 36»
учитель химии
Курган Юлия Сергеевна
Тема урока: Щелочные металлы.
Задачи урока:
Образовательная – ознакомить учащихся со щелочными металлами, их положением в периодической системе химических элементов, физическими и химическими свойствами, а также соединениями щелочных металлов.
Развивающая – продолжить развитие умений анализировать, делать предположение и выводы, а также навыков работы с наглядным материалом.
Воспитательная – продолжить формирования общего научного мировоззрения и интереса к предмету.
Ключевые компетенции:
Информационно-познавательная: умение работать с дополнительной литературой, конспектировать, выбирать главное, делать выводы.
Коммуникативная: ведение дискуссии, умение доказать свою точку зрения.
Предметные:
- исследовать физические и химические свойства щелочных металлов;
- изучить положение щелочных металлов в периодической системе химических элементов.
Тип урока – изучение нового материала.
Методы урока – рассказ с элементами беседы в сопровождении мультимедийных демонстраций.
Оборудование – ТСО (мультимедийный проектор).
Ход урока:
Организационный этап (1-2 мин).
Этап изучения нового материала.
Учитель называет тему и цель урока, комментирует план (содержание) урока. СЛАЙД № 1-2
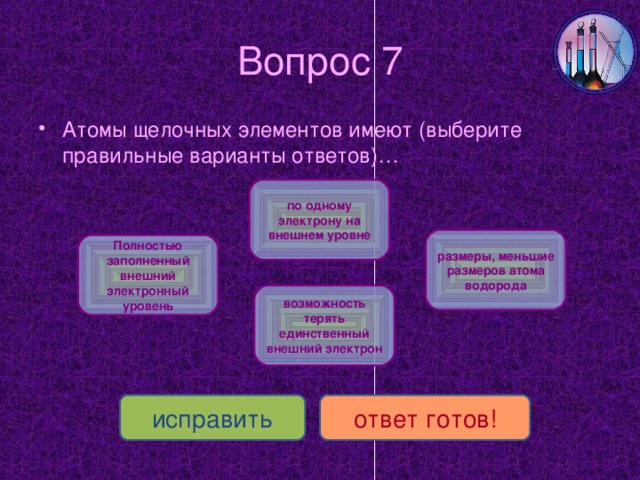
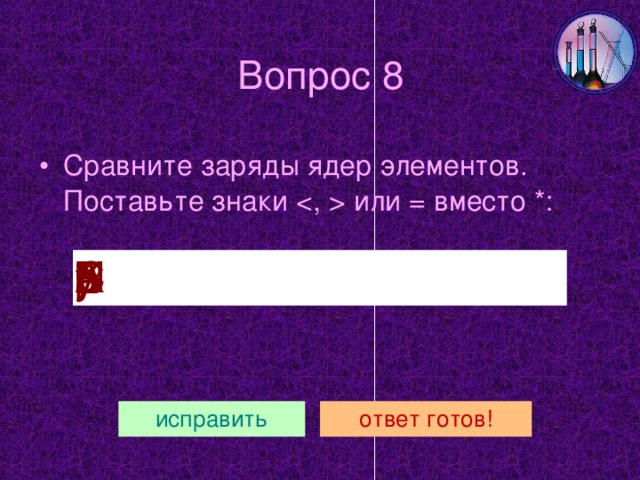
Щелочные металлы литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr находятся в главной подгруппе I группы Периодической таблицы Д.И. Менделеева.
Учитель обращает внимание ребят на ПСХЭ Д.И. Менделеева, а затем на СЛАЙД № 3
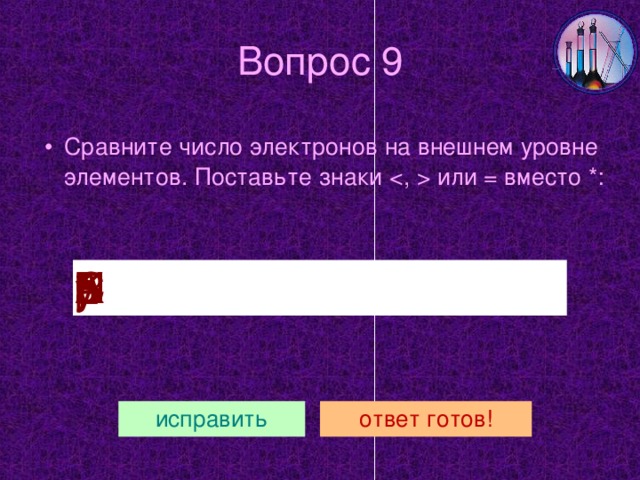
Наиболее важные из них в практическом отношении – натрий и калий. Схемы строения их атомов даны в таблице данного слайда.
Учитель предлагает перенести в тетрадь данную таблицу и самостоятельно продолжить ее для рубидия Rb и цезия Cs .

Через 2-3 минуты ребятам предлагается проверить написание размещение электронов по энергетическим уровням и электронные формулы рубидия Rb и цезия Cs. Двум ученикам предлагается выйти к доске.
Учитель предлагает поговорить о распространении в природе щелочных металлов. СЛАЙД № 4
Щелочные металлы встречаются в природе только в составе соединений, ввиду своей высокой химической активности.
Из соединений щелочных металлов широко распространены в природе лишь соединения натрия и калия.
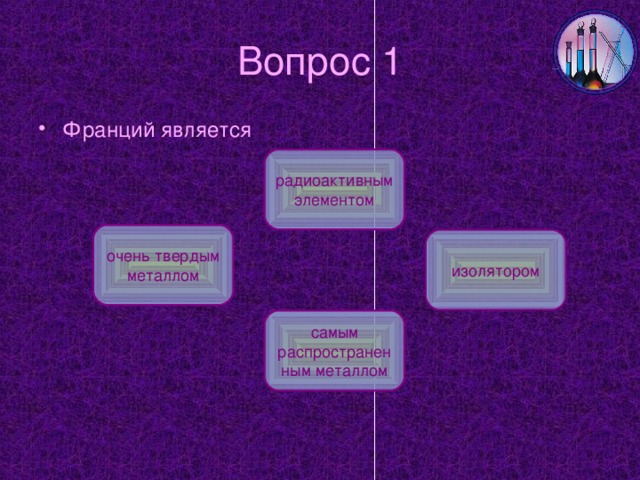
Na-2,64% (по массе), K-2,5% (по массе), Li, Rb, Cs-значительно меньше, Fr- искусственно полученный элемент
NaCl - поваренная соль (каменная соль), галит
Na2SO4· 10H2O - глауберова соль
NaNO3 - чилийская селитра
Na3AlF6 - криолит
Na2B4O7· 10H2O - бура
KCl - сильвин
KCl· NaCl - сильвинит
СЛАЙД № 5 Литий был открыт шведским химиком А. Арфведсоном в 1817 г. и по предложению Й. Берцелиуса назван литием (от греч. литос - камень), так как, в отличие от калия, который до тех пор находили в золе растений, он был обнаружен в камне.
Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 году при электролизе едких щелочей.
Й. Берцелиус предложил назвать элемент №11 натрием (от араб. натрум - сода), а элемент №19 по предложению У. Гилберта получил название «калий» (от араб. алкали - щелочь).
СЛАЙД № 6 Все щелочные металлы серебристо-белого цвета с незначительными оттенками, легкие, мягкие и легкоплавкие. Их твердость и температура плавления закономерно снижаются от лития к цезию.
СЛАЙД № 7 Литий - Lithium (Li) В виде простого вещества литий - мягкий серебристо-белый металл (т. пл. 180,5 °С, т. кип. 1336 °С). Из металлов он самый легкий (пл. 0,539 г/см3).
Судьба самого легкого металла внешне небогата событиями. Он был третьим по счету щелочным металлом, обнаруженным в природе. Содержание лития в земной коре составляет 0,02% (мол. доли).
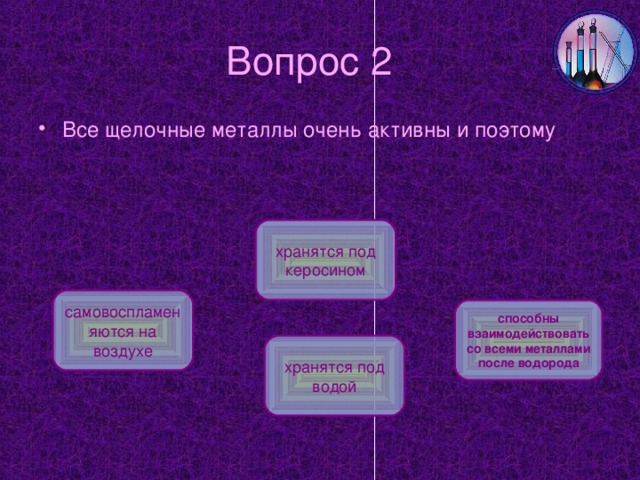
СЛАЙД № 8 Натрий - Natrium (Na) В виде простого вещества натрий - легкий (пл. 0,97 г/см3), мягкий серебристо-белый металл (т. пл. 97,8 °С, т. кип. 882,9 °С). На воздухе окисляется (хранят под слоем керосина или парафина). Бесцветное пламя газовой горелки окрашивается натрием в желтый цвет. Натрий - исключительно активный металл. Содержание его в земной коре составляет 2,4% (мол. доли).
СЛАЙД № 9 Калий - Kalium (K) - серебристо-белый металл, очень мягкий, легко режется ножом, (пл. 0,86 г/см3), легче воды, пластичен, обладает хорошей электрической проводимостью и теплопроводностью, (т. пл. 63,6 °С, т. кип. 760 °С).
В свободном состоянии калий был получен в 1807 году английским химиком Г. Дэви электролизом едкого кали. Он был открыт вместе с натрием. Полученный металл (калий) Дэви назвал потассием (от латинского "поташ", как называли карбонат калия, из которого получали гидрооксид). Содержание в земной коре этого элемента - 1,4% (мол. доли). Он относится к числу распространенных элементов.
СЛАЙД № 10 ЦезийЦезий - Cesium (Cs) - блестящий золотисто-желтый металл. После ртути - это самый легкоплавкий металл природы (т. пл. 28,4 °С, т. кип. 685 °С). Это легкий металл (пл. 1,9 г/см3).
Цезию суждено было стать первым химическим элементом, который открыли при помощи спектрального анализа. Еще в 1846 году минеролог А. Брейтхаупт, изучая минералы и руды с острова Эльба, обратил внимание на окрашенную разновидность кварцита, которую он назвал поллуксом. И только в 1860 году цезий был открыт Бунзеном и Кирхгофом в Германии. Они предложили название "цезий" (символ Cs) от "caesius" (латинское слово). В старину это слово употребляли для обозначения голубизны верхней части небосвода (металл в спектре показал отчетливую голубую линию рядом с линией стронция).
Чистый металл был получен только в 1882 году шведским химиком К. Саттербергом.
Содержание цезия в земной коре составляет 9,5*10-9 % (мол. доли).
СЛАЙД № 11 Химические свойства щелочных металлов:
Щелочные металлы являются сильными восстановителями.
Они энергично реагируют со всеми неметаллами, включая водород.
В реакциях с кислородом при горении только литий образует оксид, натрий и калий образуют пероксиды, а рубидий и цезий самовоспламеняются.
1. С кислородом:
2Na+O2=Na2O2 (видео натрий на воздухе); 2K+2O2=K2O4 (пероксиды)
4Li+O2=2Li2O (оксид лития)
2. С галогенами: 2Na+Cl2=2NaCl
3. С серой при нагревании: 2Li+S=Li2S (сульфид)
4. Литий взаимодействует с азотом: 6Li+N2=2Li3N ( нитрид)
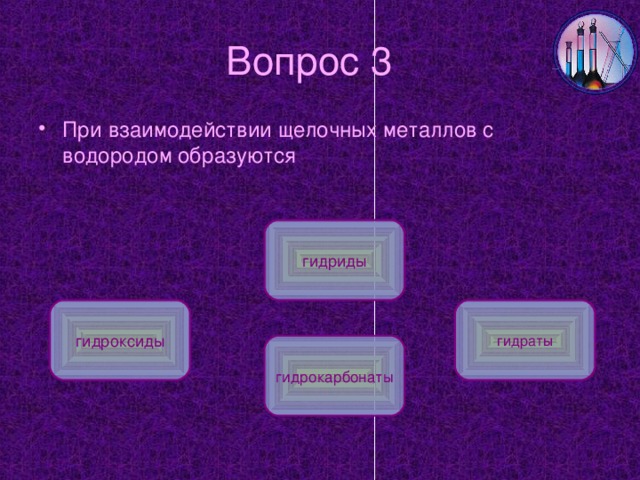
5. С водородом при нагревании: 2Na+H2=2NaH (гидрид)
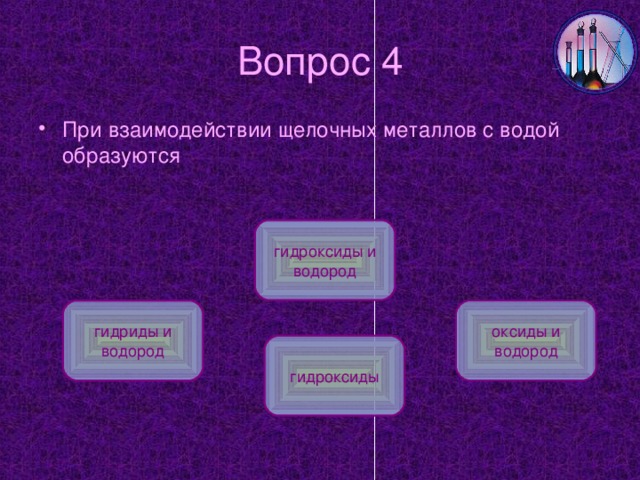
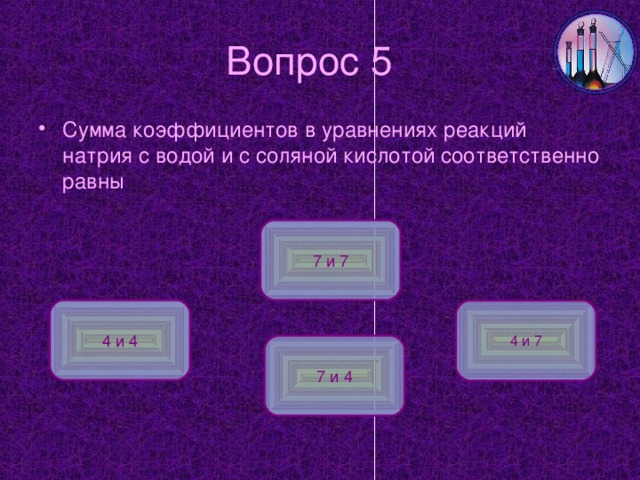
6. С водой: 2Na+2H2O=2NaOH+H2 (видео: Литий, натрий, калий с водой).
СЛАЙД № 12 Получение щелочных металлов.
Т.к. щелочные металлы - это самые сильные восстановители, их можно восстановить из соединений только при электролизе расплавов солей:
2МеCl"2Ме0+Cl20#
на катоде: Ме++1e = Ме0 (восстановление),
на аноде: 2Cl--2e = Cl20 (окисление)
СЛАЙД № 13 Соединения щелочных металлов.
Оксиды Ме2O – твердые вещества.
Гидроксиды (едкие щелочи) МеOH - белые, кристаллические вещества, гигроскопичны; хорошо растворимы в воде (с выделением тепла). В водных растворах нацело диссоциированы.
KOH - едкое кали,
NaOH - едкий натр, каустическая сода.
Соли - типично ионные соединения, как правило - хорошо растворимы в воде, кроме некоторых солей лития. Образованные слабыми кислотами сильно гидролизуются.
Na2CO3 · 10H2O - кристаллическая сода,
Na2CO3 - кальцинированная сода,
NaHCO3 - питьевая сода,
K2CO3 - поташ.
Видео: Окрашивание пламени солями натрия
Видео: Окрашивание пламени солями калия
Видео: Окрашивание пламени солями лития
3. этап закрепления нового материала.
Учитель предлагает всем вместе ответить на следующие вопросы теста.
Презентация теста «Щелочные металлы».
4. Инструктаж домашнего задания.