МБОУ Ясенецкая СОШ
Павловский район
Нижегородская область
Конспект урока
Предмет : химия
Программа :
О.С. Габриелян « Программа курса химии 8-11 классов общеобразовательных учреждений», издательство «Дрофа», 2005г.
Учебник:
Габриелян О.С. Химия-8. М.: Дрофа, 2008, 270 с.;
Тема урока: «Реакции обмена»
8 класс
Тип урока: урок - беседа
Работа учителя химии
Ясенецкой общеобразовательной
средней школы
Рыжовой Марины Евгеньевны
Образование – высшее,
стаж работы – 15лет
2009 - 2010 год
Тип урока: изучение нового материала ( урок- беседа, сопровождаемый демонстрационными и лабораторными опытами)
По характеру познавательной деятельности:
объяснительно – иллюстрационный, частично-поисковый, проблемный.
По источнику знаний и характеру восприятия: словесный, наглядный, практический.
Цель : формирование представлений о реакции обмена.
Задачи:
Обучающие: рассмотреть сущность данного типа реакции; научить учащихся писать уравнения реакций обмена; сравнивать конкретные уравнения химических реакций и узнавать тот или иной тип реакции по химическому уравнению; формировать навык проведения лабораторного опыта и умение оформлять результаты учебного эксперимента;
Развивающие: развить умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку, опираясь на знания химии; способствовать развитию умений анализировать и обобщать, делать выводы в процессе лабораторных опытов; формировать способности к адекватному само- и взаимоконтролю.
Воспитательные: продолжить формирование научного мировоззрения учащихся – химические процессы это одна из форм вечного движения окружающего нас мира; воспитывать культуру общения через работу в парах
«ученик – ученик », «учитель–ученик», в группах; воспитывать такие качества личности, как инициатива, стремление к самостоятельному поиску.
Оборудование : компьютер, проектор, экран, презентация с этапами урока и контролирующими вопросами, лабораторное оборудование для проведения опыта, бланки инструкции для проведения опыта и алгоритм отчета, периодическая система химических элементов Д.И.Менделеева, таблица растворимости веществ, карточки задания для самостоятельной работы разного уровня.
Реактивы:
Спички; оксид меди (II), растворы гидрокcидов натрия и калия, растворы соляной и серной кислот, хлорид железа(III), хлорид меди (II), хлорид бария, нитрат серебра, хлорид натрия, сульфат натрия, фенолфталеин, лакмусовая бумага
Форма работы:
фронтальная
парная
групповая
Применяемые технологии (элементы):
ИКТ
Учебное сотрудничество
Критическое мышление
ХОД УРОКА
Организационный момент
Актуализация знаний
Урок начинается с фронтальной беседы по изученному материалу. В ходе беседы учитель задает вопросы. За каждый правильный ответ полагается фишка. В конце урока по числу набранных фишек выставляются отметки. Критерии перевода числа фишек в отметку: на «5» нужно набрать 5 фишек, на «4» – 4 фишки.
( фронтальная беседа проверки фактического материала)
Учитель. Мы изучаем главу «Изменения, происходящие с веществами». Какие два вида изменений мы изучили?
Ученик: Физические и химические явления.
Учитель: В чем отличие химического явления от физического?
Ученик. В результате химического явления изменяется состав вещества, происходит химическая реакция, а в результате физического состав остается прежним.
Учитель: По каким признакам можно определить, что произошла химическая реакция?
Ученик: О протекании химической реакции можно судить по визуальным признакам: изменение цвета, выделение газа, выпадение или растворение осадка, появление запаха, выделение света, выделение тепла.
Учитель: Что называется химическим уравнением?
Ученик: Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков.
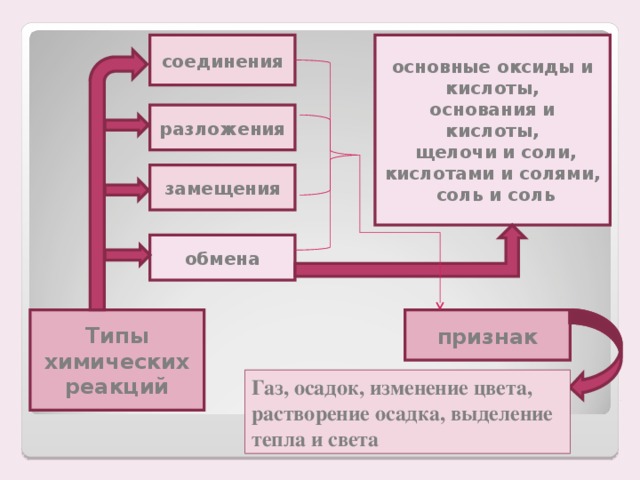
Учитель: Какие типы химических реакций вы знаете?
Ученик: Нам известны химические реакции трех типов: соединения, разложения, замещения.
Учитель: В чем сходство и различие реакции соединения и разложения?
( вопрос на сравнение)
Ученик: Сходство это химические явление. Отличие – это противоположные процессы.
Учитель: Демонстрирую опыт взаимодействие кальция с водой. Почему раствор приобрел малиновую окраску? ( проблемный вопрос)
Самостоятельная работа ( задание на развитие мышления)( 8 - мин)
| В а р и а н т 1 |
| Расставьте коэффициенты в уравнениях реакций и укажите тип каждой реакции, подчеркните одной чертой формулы простых веществ, двумя чертами формулы сложных веществ. |
| 1 | СО + О2 → СО2
|
|
| 2 | NaNO3 → NaNO2 + O2
|
|
| 3 | CuO + Al → Al2 O3 + Cu,
|
|
| 4 | HBr → H2 + Br2
|
|
| Критерии оценки Максимально можно набрать 5 баллов (по 0,5 балла за правильно расставленные коэффициенты в каждом уравнении и по 0,5 балла за верно указанный тип реакции, по 0,5 балла за все найденные формулы сложных веществ и по 0,5 балла за все найденные формулы простых веществ). «5» – 5- 4,5балла, «4» – 4 - 3,5балла, «3» – 3- 2,5балла. |
| В а р и а н т 2 |
| Расставьте коэффициенты в уравнениях реакций и укажите тип каждой реакции, подчеркните одной чертой формулы простых веществ, двумя чертами формулы сложных веществ. |
| 1 | KClO3 → KCl + O2,
|
|
| 2 | Al + HCl → AlCl3 + H2
|
|
| 3 | KNO3 → KNO2 + O2.
|
|
| 4 | Fe + О2 → Fe2 О3
|
|
| Критерии оценки Максимально можно набрать 5 баллов (по 0,5 балла за правильно расставленные коэффициенты в каждом уравнении и по 0,5 балла за верно указанный тип реакции, по 0,5 балла за все найденные формулы сложных веществ и по 0,5 балла за все найденные формулы простых веществ). «5» – 5- 4,5балла, «4» – 4 - 3,5балла, «3» – 3- 2,5балла.
|
После выполнения заданий учащиеся, сидящие за одной партой, обмениваются работами. Происходит взаимная проверка работ с помощью ответов на экране и выставление отметок по вышеуказанным критериям.
Учитель. Ребята, поднимите руки, кто выполнил работу на «5». А кто справился на «4», на «3»? Итак, подводя итог сегодняшней самостоятельной работы, я могу сказать, что вам xорошо известны три типа химических реакций: реакции соединения, разложения и замещения. Перед нами стоит задача изучить еще один тип химических реакций – реакции обмена.
Операционно - исполнительская часть
Стадия вызова.
Учитель. Ребята, по названию типа реакции предположите, в чем сущность реакции обмена.
Ученик. Сущность такой реакции в том, что вещества обмениваются своими составными частями.
Учитель. Какие вещества – простые или сложные – могут обмениваться своими составными частями?
Ученик. Оба вещества должны быть сложными.
Учитель: Попытайтесь сформулировать правило.
Ученик отвечает ( на экране появляется правильный ответ)
Учитель. Как выглядит общая схема реакции обмена?
Ученик записывает на доске общую схему реакции обмена:
АВ + СD = АD + СВ.
Учащиеся возвращаются к обобщающей таблице (табл. 1) по типам химических реакций, сделанной за три предыдущих урока, и под руководством учителя заполняют последнюю строку в этой таблице.
Таблица 1
| Kлассификацыя реакций на основании количества и состава реагирующих веществ. |
| № | Тип реакции | Уравнения реакций в общем виде | Пример |
| 1 | Соединения | А + В = АВ АВ + СВ = АСВ2 | 2H2 + O2 = 2H2 O. СаО + СО2 = СаСО3 |
| 2 | Разложения | АВ = А + В. АВС2 = АС + ВС | 2 HBr = H2 + Br2 Cu(OH)2 = CuO + H2 O |
| 3 | Замещения | А + ВС = В+ АС | Fe + CuSO4 = FeSO4 + Cu. |
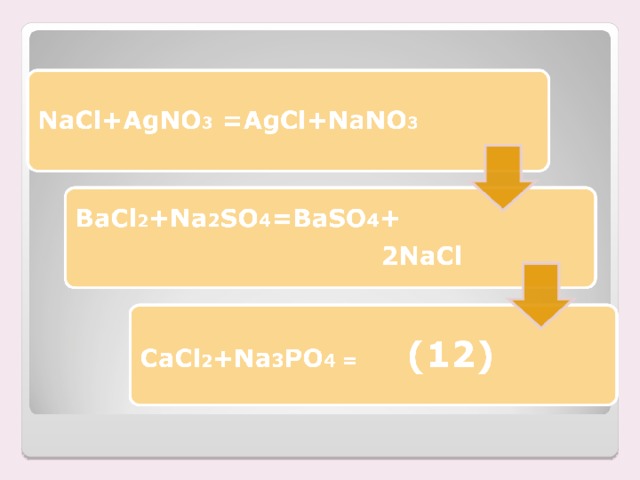
| 4 | Обмена | АВ +СД = АД+ СВ | NaOH + HCl = NaCl + H2 O СuO + H2 SO4 = СuSO4 + H2 O.
|
Самостоятельная работа исследовательского характера ( частичное самостоятельное изучение нового материала с использованием текста учебника, карточки задания с применением химического эксперимента)
Учитель.
Мы рассмотрели сущность реакции обмена с точки зрения теории. Для практической проверки, действительно ли происходят реакции обмена между сложными веществами, проведем лабораторную работу в группах (Учащиеся получают карточки- задания с таблицей (табл. 2) для составления отчета по лабораторной работе «Реакции обмена».) В таблице заполнена графа, дающая представление о том, что нужно сделать. Две другие графы вы заполните после выполнения опытов.
Таблица 2
| Лабораторная работа по теме « Реакции ионного обмена» |
| № опыта | Ход работы | Наблюдения | Уравнение химической реакции Выводы. |
| 1 (а, б) | Налейте в пробирку раствор гидроксида натрия, добавьте каплю раствора фенолфталеина, затем прилейте раствор соляной кислоты. Что наблюдаете?
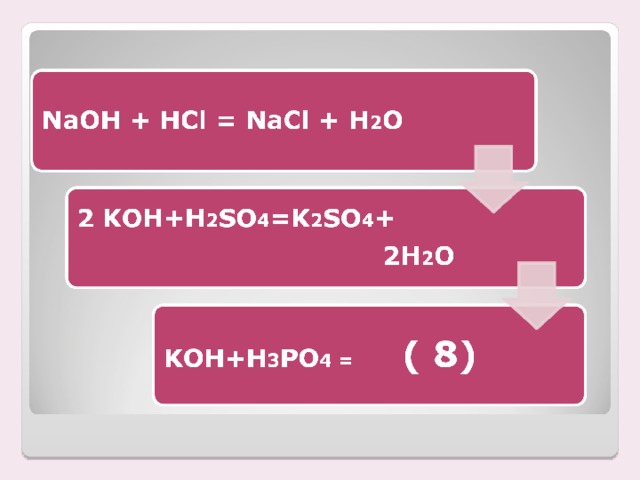
Налейте в пробирку раствор гидроксида калия, добавьте каплю раствора фенолфталеина, затем прилейте раствор серной кислоты. Что наблюдаете? | Индикатор в растворе щелочи стал малиновым, а при добавлении кислоты обесцветился |
NaOH + HCl = NaCl + H2 O Произошла химическая реакция: это реакция обмена, т.к. щелочь и кислота обменялись своими составными частями
|
| Индикатор в растворе щелочи стал малиновым, а при добавлении кислоты обесцветился |
2KOH + H2 SO4 = = K2SO4 + 2H2 O. Произошла химическая реакция: это реакция обмена, т.к. щелочь и кислота обменялись своими составными частями |
| 2 (а, б) | K раствору хлорида железа(III) добавьте по каплям раствор гидроксида натрия. Что наблюдаете?
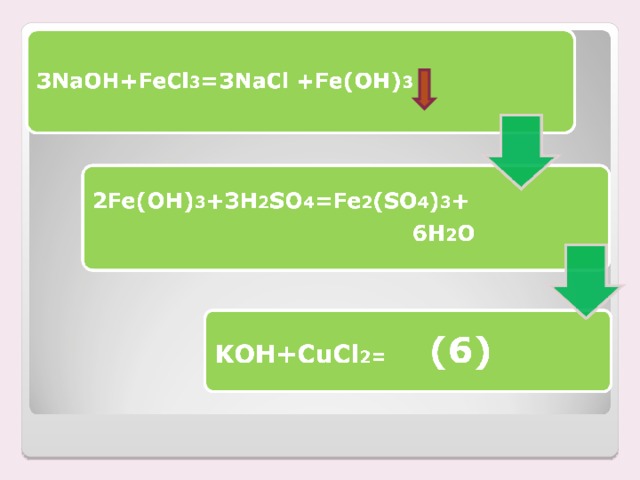
| Выпал бурый осадок | FeCl3 + 3NaOH = = Fе(OН)3 + 3NaCl. Произошла химическая реакция это реакция обмена, т.к. соль и щелочь обменялись своими составными частями |
| K полученному осадку добавьте раствор серной кислоты. Что наблюдаете?
| Бурый осадок растворился | 2Fe(OН)3 + 3 H2 SO4 = Fе2(SO4)3 + 6H2 O. Произошла химическая реакция: Это реакция обмена, т.к. нерастворимое основание и кислота обменялись своими составными частями |
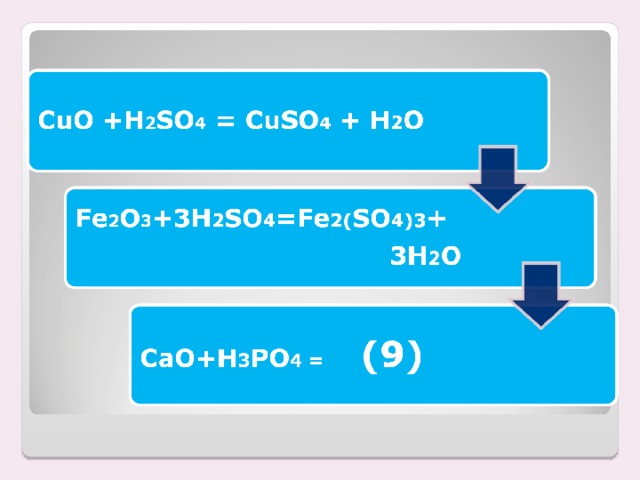
| 3 | В пробирку насыпьте порошок оксида меди(II), добавьте серной кислоты и нагрейте в верхнем пламени спиртовки | Черный порошок растворился, образовался голубой раствор | СuO + H2 SO4 = СuSO4 + H2 O. Произошла химическая реакция: Это реакция обмена, т.к. оксид и кислота обменялись своими составными частями
|
| 4 (а,б) | В пробирку налейте раствор хлорида натрия и добавьте несколько капель раствора нитрата серебра. Что наблюдаете?
В пробирку налейте раствор сульфата натрия и добавьте несколько капель раствора хлорида бария. Что наблюдаете?
| Выпадает белый осадок. | NaCl + Ag NO3 = Ag Cl + Na NO3 Произошла химическая реакция: Это реакция обмена, т.к. сложные вещества соли обменялись своими составными частями
Na2SO4 + Ba Cl2 = 2 NaCl + Ba SO4 Произошла химическая реакция: Это реакция обмена, т.к. сложные вещества соли обменялись своими составными частями
|
Учитель: Напомним правило по технике безопасности.
Ученик: Работать с растворами кислот и щелочей нужно осторожно, т.к. они опасны.
С растворами работать по принципу «не разлей», с твердыми веществами – по принципу «не рассыпь».
Пробирку с веществами нагревайте в верхней части пламени спиртовки, прогревая сначала всю пробирку, а затем ее дно.
Учитель: Кто может сказать, каковы правила пользования спиртовкой?
Ученик: Сначала нужно проверить резервуар спиртовки, поправить фитиль, затем зажечь. После нагревания потушить пламя спиртовки колпачком.
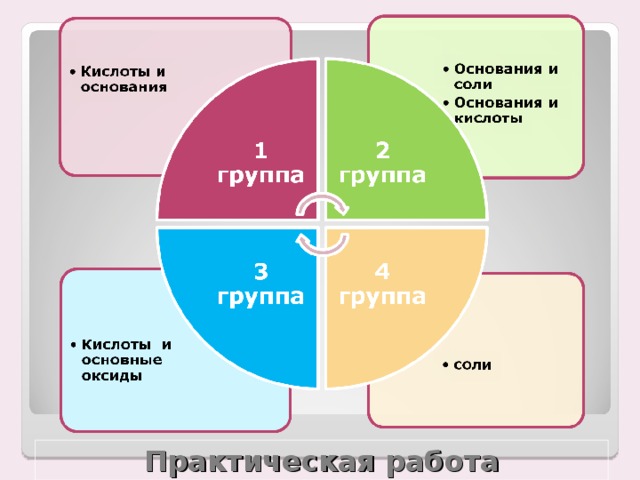
Проводятся опыты в группах, каждая группа выбирает себе блок для исследования и готовится к защите.
1 группа: взаимодействие кислот и оснований
2 группа: взаимодействие оснований и солей
3 группа взаимодействие основных оксидов и кислот
4 группа: взаимодействие солей.
(обсуждение результатов опытов)
Учитель: Кто в работе использовал фенолфталеин? Зачем при проведении опытов вы использовали фенолфталеин?
Ученик: Фенолфталеин используется для того, чтобы можно было увидеть, как изменяется среда раствора. Мы смешали вещества: щелочь – щелочная среда и кислоту кислотная среда . Поскольку исходные вещества и продукты реакции бесцветны, изменение цвета индикатора и будет признаком химической реакции.
Учитель: Данную реакцию называют реакцией нейтрализации. Почему?
Ученик: От слова нейтральная среда. Так как образовались соль и вода.
Учитель: Реакция нейтрализации – частный случай реакции обмена.
Проверьте правильность написания уравнений реакций к первому и второму опытам (предлагается запись уравнений реакций на экране). Являются ли данные реакции реакциями обмена?
Ученик: Реакция между щелочью и кислотой относится к реакциям обмена, в ней два сложных вещества обмениваются составными частями.
(обсуждение результатов опытов 2 группы)
Учитель: По каким признакам можно определить, что реакции прошли?
Ученик: Образовался осадок.
Учитель: Проверьте правильность записанных уравнений реакций (предлагается запись уравнений реакций на экране). Относятся ли данные реакции к реакциям обмена?
Ученик: Эти реакции относятся к реакциям обмена, т.к. в них участвуют сложные вещества, которые обмениваются составными частями.
Учитель: Третья группа, какие вещества исследовали вы?
Ученик: Основные оксиды, нерастворимые основания также вступают в реакции обмена с кислотами.
Учитель: Какие признаки говорят о том, что реакция прошла?
Ученик: Осадок растворился, образовался раствор голубого цвета.
Учитель: Как вы записали уравнение реакции?
(Ученик у доски записывает уравнение реакции). Итак, в реакцию обмена вступают оксид металла и кислота.
Другой ученик записывает реакцию нерастворимого основания и кислоты.
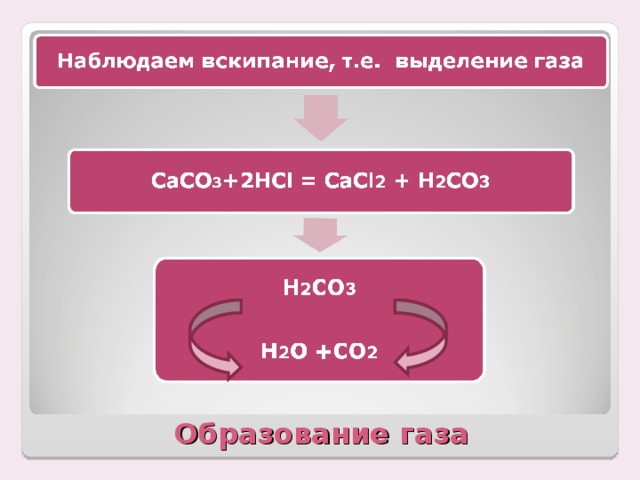
Учитель: Хорошо. Давайте пронаблюдаем еще один процесс. Демонстрирую взаимодействие карбонат натрия и кислоты. Ученик работает у доски с уравнением все ученики в тетради.
Учитель: Что наблюдаете ?
Ученик: Вскипание , выделение газа.
Учитель: Почему это произошло? (Разбираем, откуда появился газ)
Ученики: Вспоминают свойства кислот и объясняют, что угольная кислота распадается на углекислый газ и воду.
Рефлексивно оценочная часть.
( вопросы для проверки фактического материала урока)
Учитель: Подведем итог нашей работы. Сколько типов химических реакций вы теперь знаете?
Ученик: Мы знаем четыре типа химических реакций: реакции соединения, разложения, замещения и обмена.
Учитель: Вещества каких классов могут вступать в реакции обмена?
Ученик: Реакции обмена могут происходить между основаниями и кислотами, кислотами и основными оксидами, солями и щелочами, между солями, кислотами и солями, нерастворимыми основаниями и кислотами.
Учитель: Как мы можем судить, что прошла химическая реакция обмена?
Ученик: По признакам ( газ, осадок, вода, растворение осадка, изменение цвета индикатора)
Учитель: Какая реакция называется реакцией нейтрализации?
Ученик: Реакция нейтрализации – это реакция обмена между основанием и кислотой, в результате которой образуются соль и вода.
Учитель: Вот и подошел наш урок к своему завершению. Мы c вами замечательно потрудились, каждый в меру своих сил и возможностей. Сдаем свои фишки, и пока я буду выставлять оценки, запишите домашнее задание.
Домашнее задание. По учебнику О.С.Габриеляна «Химия-8» § 32, упр. 4, с. 168., повторить записи в тетради трех предыдущих уроков.
Литература
Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. 8 класс. М.: Дрофа, 2002, 416 с.;
Габриелян О.С. Химия-8. М.: Дрофа, 2008, 270 с.;
Габриелян О.С., Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Методическое пособие к учебнику О.С.Габриеляна «Химия-8» для учащихся и учителей. М.: Блик и Ко, 2001, 224 с.;
Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия. 8 класс. М.: Вентана-Граф, 2003, 224 с.
Рыбникова З.Д., Рыбников А.В. Неорганическая химия. 8-9 классы: Ключевые темы. Конспекты занятий. Контрольные и проверочные работы.-М.: Айрис-пресс, 2004.-208с.
http://him.1september.ru/
А н к е т а д л я у ч е н и к о в
Ответь, пожалуйста, на нижеперечисленные вопросы. Постарайся, чтобы твои ответы были искренними, честными и полными.
1. Твое отношение к сегодняшнему уроку (выбери вариант ответа):
а) отличный, интересный, захватывающий;
б) хороший, содержательный, заставляющий работать;
в) нормальный, обычный;
г) скучный, работа без интереса;
д) бесполезный, совсем не интересный;
2. Вспомни тему урока. __________________________________________________________________
3. Какая цель стояла перед тобой на уроке? __________________________________________________________________
4. Чему новому ты научился на уроке? __________________________________________________________________
5. Какие ранее полученные знания ты использовал на уроке? __________________________________________________________________
__________________________________________________________________
6. Какую оценку за работу на уроке ты бы поставил себе?______________________________________________________________
7. Какую оценку за работу на уроке ты бы поставил учителю? __________________________________________________________________
Спасибо за сотрудничество!