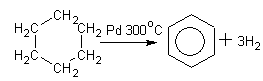| Цель: сформировать представление обучающихся о строении бензола, познакомить с его физическими свойствами, способами получения и применением. Задачи: - образовательные: обеспечение усвоения обучающимися основных понятий темы: бензол, реакция присоединения, реакции замещения, реакция тримеризация ацетилена. - развивающие: развитие химического языка, обучение составлению уравнений химических реакций для бензола, навыков работы с компьютером. - воспитательные: привитие познавательного интереса к химии, развитие мыслительной деятельности и познавательной активности. Оборудование: таблица « Бензол и его строение»; тесты. Методы: наглядно – иллюстративный, эвристический. Формы: рассказ,фронтальная беседа, вопросно – ответная форма, индивидуальная, Ход урока. Организационный момент. Мотивация учащихся. Мы с вами уже изучили предельные углеводороды - алканы, непредельные углеводороды - алкены, алкадиены, алкины. Сегодня мы с вами познакомимся с ароматическими углеводородами или аренами. Определите семантику слову ароматические (аромат). Дайте лексическое значение слову аромат. Почему эти вещества названы ароматическими? Ароматическими эти углеводороды были названы потому, что первые известные представители их обладали приятным запахом. У углеводородов этого гомологического ряда исторически сложившееся название - ароматические, которое они получили из – за того, что представители имеют характерный запах( иногда приятный, иногда- нет.)В современной жизни это производные бензола: показ благовоний, дихлофоса, ванилина, красителей, нафталина, освежителя воздуха. Позднее оказалось, что большинство веществ, которые принадлежат к этой группе не имеют ароматного запаха. Однако исторически сложившееся название этих соединений осталось. Простейший и самый важный представитель ароматических углеводородов – бензол. Мы познакомимся со строением, изучим удивительные свойства бензола, узнаем о его применение в народном хозяйстве, посмотрим занимательные опыты. III. Изучение нового материала. 1. Понятие об аренах. - Откройте тетрадь, запишите сегодняшнее число и тему урока . Бензол , строение и получение». Арены – углеводороды с общей формулой CnH2n-6, молекулы которых, содержат бензольное кольцо. Молекулярная формула бензола C6H6 А теперь давайте рассмотрим историю его открытия. Слушая мой рассказ сделайте краткий конспект истории открытия бензола. 2. История открытия Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен. Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа. Открыть бензол, как это бывает нередко помог случай. Начиная с 10-х годов XIX века в Лондоне, для освещения улиц в фонарях стали использовать светильный газ. Его получали путём сухой перегонки каменного угля и хранили под давлением в герметических сосудах. При этом в сосудах накапливалась жидкость, особенно обильно в холодную погоду. Майкл Фарадей начал изучать её и 18 мая 1825 года выделил соединение двууглеродистого водорода и приписал ему неверную формулу С2Н. В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол) Проверим ваши конспекты. Мы узнали о истории его открытии теперь посмотрим какое же строение имеет молекула бензола
3.Строение молекулы бензола. В 1865г. Кекуле предложил структурную формулу бензола. Как рассказывал впоследствии сам автор открытия А. Кекуле, он долгое время ломал голову над тем, каким образом можно было бы выразить одинаковость всех атомов углерода в бензоле и всех его водородов. Усталый, . он сел у пылающего камина и задремал. Перед его мысленным взором мелькали, как яркие змейки, цепочки из атомов углерода и водорода . Они совершали различные движения, и вот одна из них замкнулась в кольцо. Так у А. Кекуле родилась «подсказка» искомой формулы бензола: формула должна быть кольцевой — только в этом случае все шесть атомов углерода, входящие в молекулу бензола, могут быть между собой равноценны, так же как соединенные с ними шесть а томов водорода. А. Кекуле очнулся, сел и записал привидевшуюся ему кольцевую модель молекулы бензола. Так он рассказывал сам. Такого рода подсказку мы назовем познавательно-психологическим трамплином (или, короче, трамплином). Она наводит мысль ученого на правильный путь к истине, который до тех пор был закрыт для него неосознанным барьером, стоявшим на этом пути. Она не разрушает этого барьера, но указывает, как его можно преодолеть или обойти нашей мыслью. Случайное и необходимое при преодолении ППБ. К рассказанному случаю добавим следующее. Еще в детстве А. Кекуле присутствовал на суде, где разбиралось дело человека, служившего лакеем у старой графини. Он убил свою хозяйку и ограбил ее. Среди ее драгоценностей был и браслет, который застегивался на руке, подобно змею, глотающему свой хвост. Поэтому некоторые биографы А. Кекуле высказали предположение, что идея кольцевой формулы бензола могла быть подсказана ему детским воспоминанием об этом браслете. Сам А. Кекуле отличался веселым характером, был шутником и выдумщиком. Он вознамерился сочинить еще одну версию о том, как ему пришла мысль о замыкающейся в кольцо углеродной цепи. Он рассказал, что будто бы ехал в Лондоне в омнибусе на крыше и увидел, что по улице везут в цирк клетку с обезьянами, которые хватаются лапами друг за друга и машут хвостами, и он будто бы подумал, что это атомы углерода (четырехатомные) , а их хвосты — это водороды. Вдруг сцепившиеся обезьяны образовали кольцо, и он догадался, что формула бензола должна быть кольцевой. Легко можно представить еще много других версий аналогичного характера, например: плетение венка с замыканием цветочной полоски в кольцо; свертывание в колечко прутика; смыкание большого пальца руки с одним из других и т. д. Во всех этих случаях существенно и важно только одно: чтобы наблюдался процесс замыкания в кольцо двух окончаний какого-либо достаточно прямолинейного предмета. Наблюдение такого процесса, совершенно независимо от того, что представляет собой сам предмет, концы которого замыкаются, и может послужить намеком или имитацией решения задачи. Заметим, что необязательно ученому было видеть ка- кой-либо из процессов в данный момент, а достаточно его вспомнить и воспоминание о таком образе могло бы дослужить ему подсказкой, причем такой, на которую он мог вообще не обратить никакого внимания и совершенно забыть о-ней в ходе последующей разработки своего открытия. Все приведенные выше версии чисто случайные, внешние по отношению к самому творческому процессу, ничем не связанные с его существом. Однако общим в них было то, что каждое из этих случайных событий по-своему имитировало один и тот же необходимый процесс: замыкание открытой цепи в кольцо.
Как вы видите, молекула соответствующая формуле Кекуле, содержит двойные связи, следовательно для него характерны должны качественные реакции на кратные связи. А какие качественные реакции характерны для алкенов и алкинов? (Обесцвечивание перманганата калия и бромной воды) Но бензол не обесцвечивает перманганата калия и бромную воду. На какую мысль навел этот факт ученых? Пытаясь объяснить эти несоответствия , многие ученые предлагали различные варианты структуры бензола. В настоящее время бензол обозначают или формулой Кекуле или что наиболее логично шестиугольником, в котором изображают окружность. Молекула бензола имеет циклическое строение. 4. Получение бензола.
1.Дегидрирование циклоалканов ( метод Зелинского):
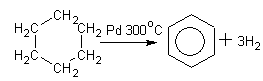
Циклогексан бензол 2..Бензол получают из каменноугольной смолы, образующейся при коксовании угля. 3..В настоящее время бензол получают из нефти. 4..Бензол получают синтетическими методами. Одним из синтетических способов - тримеризация ацетилена. 3СН ≡СН t акт. угольС6Н6
Этин бензол Теперь посмотрим какими же физическими свойствами обладает это вещество. Самостоятельно работают с текстом учебника стр.53 5. Физические свойства - Бензол - бесцветная жидкость, практически нерастворима в воде, с ароматным запахом, но пары бензола ядовиты, температура кипения=+80С, температура плавления=+5,50СЛегче воды и не растворяется в ней. У углеводородов этого гомологического ряда исторически сложившееся название - ароматические, которое они получили из – за того, что представители имеют характерный запах( иногда приятный, иногда- нет.)В современной жизни это производные бензола: показ благовоний, дихлофоса, ванилина, красителей, нафталина, освежителя воздуха - Биологическое действие( сообщение ученика) При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался. В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория. Пары бензола могут проникать через неповрежденную кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. В этом случае хроническое отравление бензолом может стать причиной лейкемии и анемии. Сильный канцероген. - Наиболее эффективные средства их обезвреживания. Сам Бензол и его производные химически малоактивны, способны к аккумуляции в организмах животных, почвах, дерновом покрове, иле, мхе. Водную среду очищают обычно засыпая участок поражения большим количеством пористого сорбента - известняка, песчаника, доломитовой крошки итп. Затем по возможности сорбент вычерпывают и захоронят. Почвы не очищают - их просто засыпают глинами или снимают верхний слой и опять засыпают. Универсальных химических агентов обезвреживания ароматических углеводородов не существует.
Что вы для себя отметили. Рассмотрев физические свойства бензола можно перейти к изучению химических свойств. 6. Химические свойства. 1. Бензол горит. (Просмотр опыта) Пламя бензола коптящее из-за высокого содержания углерода в молекуле. 2 C6 H6 + 15 O2 → 12CO2 + 6H2O Расставьте коэффициенты в уравнении. Из-за особенного строения молекулы, бензол занимает как бы промежуточное положение между алканами и алкенами, т.е. может вступать в реакции присоединения, так и в реакции замещения. Однако, в отличие от алканов, реакции замещения с бензолом протекают легче, а реакции присоединения – труднее, чем у алкенов. 2. Реакции замещения в бензоле протекают легче, чем в алканах. а) реакция галогенирования (просмотр опыта). А теперь сами напишите как бензол будет реагировать с хлором. б) реакция нитрования – взаимодействие с азотной кислотой. Нитробензол – исходное соединение для получения анилина. 3. Реакции присоединения в бензоле протекают труднее, чем в алкенах. а) реакция гидрирования б) реакция хлорирование. Несмотря на высокую непредельность молекулы бензола (по составу), он не дает характерных, качественных реакций для непредельных углеводородов: не обесцвечивает бромную воду и раствор перманганата калия. Это связано с особым строением молекулы бензола. Какие реакции характерны для бензола? А теперь узнаем где находит применение бензол 7. Применение бензола.(стр 54) Беседа по принципу ПРИЧИНА--СЛЕДСТВИЕ 1-добавка к бензину; производство 2-растворителей; 3-ацетона; 4-анилина; 5-фенола; 6-пестицидов; 7-лекарств; 8-фенолформальдегидных пластмасс. IV. Закрепление. Закрепление изученного материала. Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что знаешь. Итак, наступил момент истины на нашем уроке! Вам, ребята раздаю тест состоящий из 9 вопросов, вам необходимо ответить на вопросы, в тетради записать только номер правильного ответа, у вас получится девятизначное число. Тест. 1. Общая формула ароматических углеводородов: 1) CnH2n-2; 3) CnH2n; 2) CnH2n-6; 4) CnH2n+2. 2.Бензолу не свойственно: 1) жидкое агрегатное состояние; 2) характерный запах; 3) температура кипения 80,1º С; 4) хорошая растворимость в воде. 3. Расстояние между атомами углерода в бензоле сокращается за счет: 1) циклического строения молекулы; 2) расположения гибридных орбиталей в одной плоскости; 3) влияние π-электронного облака; 4) равномерного распределения электронной плотности. 4. Вещества с общей формулой CnH2n-6 относятся к классу: 1) алканов; 3) алкинов; 2) алкенов; 4) аренов. 5. В молекуле бензола шесть атомов углерода образуют: 1) правильный шестиугольник; 2) неправильный шестиугольник; 3) треугольник с боковыми ответвлениями; 4) квадрат с боковыми ответвлениями. 6. Состояние гибридизации атомов углерода в молекуле бензола: 1) sp; 3) sp3; 2) sp2; 4) sp и sp2. 7. При хлорировании бензола на сильном свету получается: 1) хлорбензол; 2) 1, 2, 3-трихлорбензол; 3) бромбензол; 4) гексахлорциклогексан. 8. При взаимодействии бензола с бромом в присутствии катализатора (FeBr3) получается: 1) бромбензол; 2) гексабромциклогексан; 3) 1, 3, 5-трибромбензол; 4) 1, 2-дибромбензол. 9. Бензол, как и непредельные углеводороды, вступает в реакции: 1) полимеризации; 3) окисление раствором перманганата калия; 2) гидрогалогенирования; 4) гидрирования. Слайд №8 (ключ теста) Взаимопроверка. Подведение итогов.
|