| У углеводородов этого гомологического ряда так же существует исторически сложившееся название «ароматические соединения», возникшее еще в начале 19 века для группы веществ, которые были выделены из природных источников, в основном из приятно пахнущих растительных смол, эфирных масел и бальзамов. В дальнейшем это название укрепилось за большим семейством органических соединений, обладающих некоторыми особенностями в строении и свойствах. Первым представителем этого класса является бензол. Запишите в тетради определение: Ароматические углеводороды, или арены — это углеводороды, в молекулах которых имеется одно или несколько бензольных колец. Среди 25 миллионов известных на сегодняшний день органических соединений немного найдется таких, которые оказали на развитие органической химии большее влияние, чем бензол. Интересна история его открытия. О ней подготовил доклад и расскажет нам …(вызывает ученика, подготовившего доклад на тему «История открытия бензола»). (Приложение 2) На минуты станем исследователями и попробуем вывести формулу бензола. Решим задачу: Плотность паров данного вещества по воздуху 2,69. Массовая доля углерода- 92,3%, водорода- 7,7%. Определите молекулярную формулу вещества. (Приложение 3) Итак, мы нашли молекулярную формулу бензола: С6Н6. Общая формула аренов: CnH2n-6
После открытия бензола дискуссия о его строении велась в науке очень долго. Об этом мы послушаем еще один доклад. Вызывает ученика, подготовившего доклад на тему «Структура молекулы бензола ( по Кекуле)». (Приложение 2) Как вы видите, молекула, соответствующая формуле Кеккуле, содержит двойные связи, следовательно бензол должен иметь ненасыщенный характер, то есть вступать в реакций присоединения. Посмотрим так ли это. Какие реакции являются качественными на кратные связи? Проверим обесцветит ли он бромную воду и раствор перманганата калия. Просмотр видеоролика «Отношение бензола к бромной воде и раствору перманганата калия» Какие результаты опыта мы увидели? Почему же так происходит? Какой мы должны сделать вывод? Совершенно верно. Для выяснения причин обратимся к электронному строению молекулы. Все атомы углерода в молекуле бензола лежат в одной плоскости и образуют кольцо. Каждый из них находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Негибридные р-орбитали всех атомов углерода взаимодействуют между собой путем бокового перекрывания. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца. Это означает, что в молекуле бензола нет трех отдельных двойных связей (как в формуле Кекуле), а π-электронная плотность делокализована, т.е. равномерно распределена между всеми атомами углерода. Поэтому американский ученый Л.Полинг предложил структурную формулу бензола изображать в виде шестиугольника с окружностью внутри. Таким образом, химические связи в бензоле не одинарные и не двойные, а как принято говорить полуторные, промежуточные по своему характеру. Эти связи еще называют ароматическими, они прочнее π – связей (поэтому бромная вода не обесцветилась – атомы брома не присоединяются). Зафиксируйте формулу в тетради и запишите основные выводы электронного строения молекулы. 1)Атомы углерода находятся в состоянии sр2- гибридизации. 2)Валентный угол –120° 3)Длина связи С-С 0,140нм 4)Между атомами углерода и углерода и водорода образуются σ- связи, лежащие в одной плоскости 5) Единая π - электронная система, состоящая из 6 р – электронов. Существуют так же соединения, молекулы которых содержат несколько циклических структур. Простейший гомолог бензола – толуол (метилбензол). Запишите его формулу. Следующий гомолог представлен в виде 4 изомеров- изомерия положения нескольких заместителей. Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в кольце нумеруют, начиная от старшего заместителя к младшему. Если заместители одинаковые, то нумерацию проводят по короткому пути.
Прочитайте в учебнике о способах получения аренов. Выпишите в тетрадь уравнения реакции. Просит одного из учеников озвучить, выписанные методы получения аренов.
Сейчас посмотрите видеоролик «Изучение физических свойств бензола» и кратко запишите их в тетрадь. Перечислите физические свойства бензола?
Какие выводы мы должны с вами сделать?
Рассмотрим химические свойства бензола. Как вы думаете, какие реакции характерны для бензола? По химическим свойствам бензол занимает как бы промежуточное положение между предельными и непредельными углеводородами, то есть вступает в реакции замещения и присоединения. Но реакции замещения у бензола идут легче, чем у предельных, а реакции присоединения – труднее, чем у непредельных углеводородов и требуют жестких условий. 1.Реакции замещения: а)Реакция (галогенирования) хлорирования бензола протекает в присутствии катализатора хлорида железа (III): 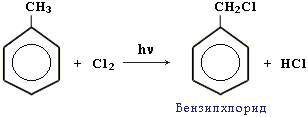
Полученный продукт также называют фенилхлорид, так как одновалентный радикал С6Н5 – называют фенилом. б)Реакция нитрования. При взаимодействии бензола с азотной кислотой в присутствии концентрированной серной кислоты в качестве катализатора, происходит замещения атома водорода на нитрогруппу –NO2: 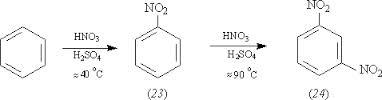
Эта реакция имеет очень важное промышленное значение. Восстановлением образовавшегося в этой реакции нитробензола (реакция Зинина) получают – анилин, вещество которое применяется для получения анилиновых красителей. 2.Реакции присоединения: а)Реакция хлорирования идет при освещении ультрафиолетовым светом и присоединяет 3 молекулы хлора: 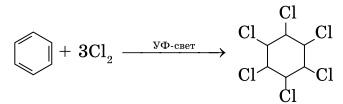
б)Каталитическое гидрирование бензола протекает при высокой температуре в присутствии платины: 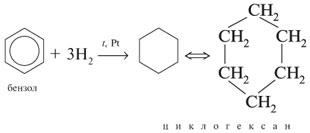
3.Бензол горит на воздухе коптящим пламенем: 2С6Н6 + 15О2 12СО2 + 6Н2О.
Рассмотрите иллюстрацию в учебнике на стр.135 и слайд мультимедийной презентации и назовите области применения аренов.
|
Записывают определение в тетрадь.
Ученик читает доклад.
Ученики в тетрадях решают задачу, один из учеников записывает решение на доске.
Ученик озвучивает доклад.
Реакции обесцвечивания бромной воды и обесцвечивания раствора перманганата калия.
Бензол не обесцветил бромную воду и раствор перманганата калия. Вывод: что три двойные связи, сведенные в месте в одном шестичленном кольце ведут себя как-то по-новому.
Ученики делают записи в тетради.
Ученики фиксируют в тетради формулу толуола.
Ученики работают с учебником, выписывают уравнения реакции в тетрадь.
Ученик перечисляет способы получения аренов.
Смотрят видеоролик, фиксируют свойства бензола в тетрадях.
Несколько учеников читают записи, которые сделали в тетрадях. Бензол токсичен, поэтому работа с ним в условиях школы недопустима.
Ответы учеников.
Ученики записывают реакции в тетрадь.
Ученики смотрят картинки и называют области применения аренов. Выписывают в тетрадь. | 



















