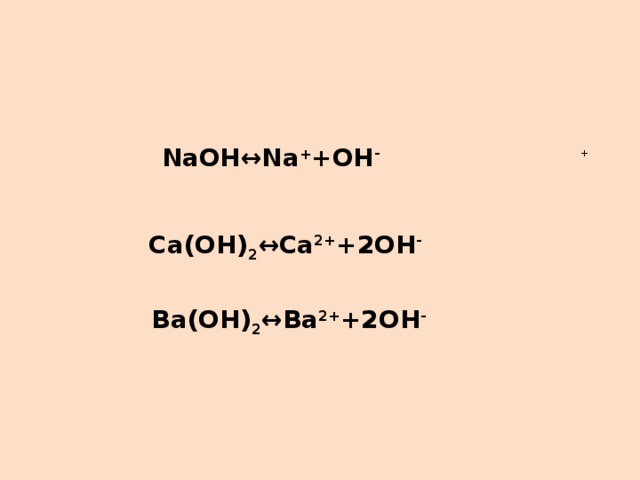ТЕМА УРОКА : Основания, их классификация и химические свойства в
свете теории электролитической диссоциации.
II слайд:
ЦЕЛЬ УРОКА:
1.Сформировать понятия об основаниях как классе
электролитов.
2. Рассмотреть их классификацию по различным
признакам.
3. Познакомить практически с химическими свойствами
оснований в свете теории электролитической
диссоциации.
4. Развивать умения и навыки работы с химическими
реактивами и химическим оборудованием.
5. Учить сравнивать, анализировать, делать выводы.
6. Совершенствовать умения и навыки в написании
формул веществ и уравнений химических
реакций.
Задачи урока: Учиться проводить химические реакции и записывать
уравнения химических реакций в молекулярной,
полной и сокращенной ионной формах;
различать свойства растворимых и нерастворимых
оснований.
Девиз урока: «Все познается в сравнении».
Оборудование и реактивы: образцы оснований: NaOH; KOH; вода; раствор
HCl; CuSO4(раствор), фенолфталеин; спиртовка;
спички; зажим; пробирки;  табл « Изменение окраски индикаторов в различной среде»; табл. « Правила техники безопасности при работе с химическими реактивами».
табл « Изменение окраски индикаторов в различной среде»; табл. « Правила техники безопасности при работе с химическими реактивами».
Ход и содержание урока.
Орг. момент.
Актуализация знаний учащихся.
Какие классы веществ мы знаем?
Дать определение кислотам в свете теории электролитической диссоциации.
Какой класс веществ называют основаниями? Дать ответ исходя из строения молекулы данных веществ и теории электролитической диссоциации.
III слайд: Определение оснований.
IV слайд: Составьте формулы оснований, образованных следующими
металлами и назовите их:
Cu(II)
Na
Cr(III)
Ca
Ba
Al
Двое учащихся выполняют задание на доске, а учащиеся на листочках. Затем самопроверка на экране.
V СЛАЙД.
4)запишите уравнения электролитической диссоциации оснований, формулы которых вы составили.
Ответ: самопроверка через экран проектора.
III. Изучение нового материала.
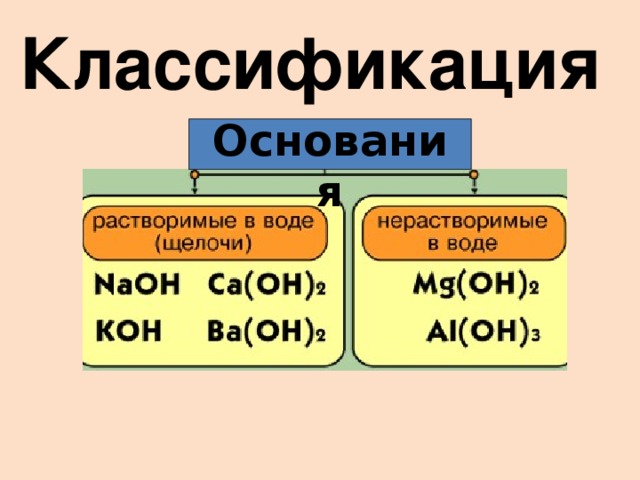
1. Классификация оснований.
Класс оснований очень многочисленный.
На какие группы делятся все основания по отличительным признакам?
VI слайд.
Это самое простое деление. Давайте познакомимся с признаками классификации оснований. (Откройте учебник стр. 160 таб.11)
2. Физические свойства оснований.
Каждое химическое вещество имеет определенные свойства. Они могут быть физическими и химическими. Физические свойства оснований мы уже знаем.
Демонстрация гранул NaOH; KOH; Ca(OH)2
Какими
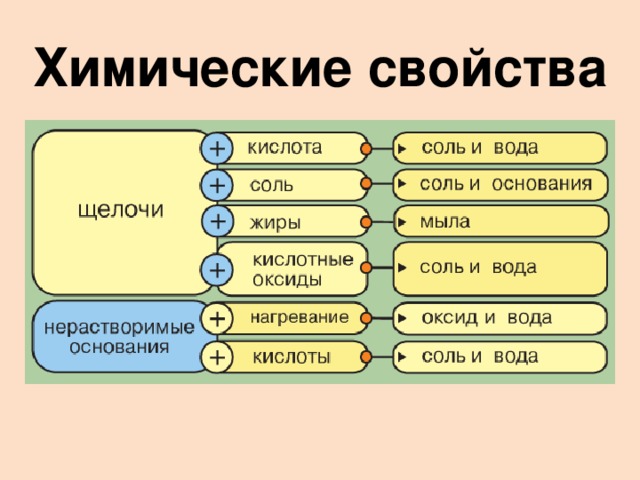
3. Химические свойства оснований.
Какими же химическими свойствами обладают основания?
Мы сделали запрос в лабораторию химических исследований и вот какой ответ получили:
СЛАЙД-VII.
Но вы знаете ,что в нашей науке теоретические обоснования необходимо подтвердить практически. Давайте на практике проверим свойства оснований. На столах у вас инструктивные карты, проведем лабораторную работу. Будем работать в парах. Какие же правила безопасности мы должны соблюдать? Таблица с правилами Т Б.
Выполнение лабораторной работы.
На доске и в тетради учащиеся записывают уравнения реакций.
IV.ОБЩИЙ ВЫВОД ПО УРОКУ:
СЛАЙД-VIII.
СЛАЙД-IX. ЗАПОМНИТЕ!
V.Закрепление: Тест»ОСНОВАНИЯ»
Карточки-задания.
VI. ИТОГ УРОКА:
1. Вещества какого класса мы рассмотрели?
2. Дать определение данного класса веществ.
3. Какими свойствами обладают вещества данного класса?
VI. Домашнее задание.
СЛАЙД-X.