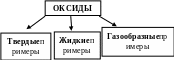
- закрепить понятие «оксиды»; изучить основные правила химической номенклатуры оксидов и научиться называть их;
- познакомить с классификацией оксидов; ввести понятия «основный оксид», «кислотный оксид», «амфотерный оксид», «солеобразующий и несолеобразующий оксиды»;
- расширить знания о применении и значении оксидов в природе и жизни человека.
- формировать умения сравнивать, выявлять общие и существенные признаки веществ, делать выводы;
- формировать умение устанавливать взаимосвязь между составом, названием и свойствами веществ;
- формирование самостоятельности, познавательного интереса, ценностного отношения к химии как науке и учебному предмету;
Развитие самостоятельности, уважения друг к другу, терпимости.
Научиться обобщать полученную информацию, классифицировать объекты по предложенным критериям, выполнять учебное задание в соответствии с планом, оценивать свои учебные достижения.
Давать определение «оксиды», «кислотные оксиды», «основные оксиды», распознавать оксиды среди других веществ, составлять формулы оксидов и называть их, описывать свойства оксидов, методы их получения с помощью уравнений химических реакций.
Беседа, объяснение, постановка и решение учебных проблем.
| ЭТАП УРОКА | ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ | ДЕЯТЕЛЬНОСТЬ УЧЕНИКА |
| 1.Оргмомент
Цель: создать мотивацию к учебной деятельности | Взаимное приветствие, проверка готовности обучающихся к уроку, проверка оборудования. | |
| 2. Актуализация знаний.
Организация проблемной ситуации.
Цель: актуализация имеющихся знаний, обучающихся по пройденной теме. | – Человека окружает огромное количество химических веществ. По составу они делятся на простые и сложные.
- Вспомните, какие вещества называются простыми?
- Хорошо. Приведите примеры таких веществ? - Молодцы. А какие вещества называются сложными?
- Приведите, пожалуйста, примеры таких веществ?
Учитель предлагает загадку. Их получают путем горения, или сложных веществ разложением. В них два элемента, один – кислород. Я отнесу к ним и известь и лед. |
(Ответ). Простыми – называются вещества, которые образованны атомами одного химического элемента. (Ответ). O2, H2, Fe, Cu, Al и т.д. (Ответ). Сложными – называются вещества, которые образованы атомами разных химических элементов. (Ответ). H2O, CO2, NaCl, сахар и т.д.
Обучающиеся предполагают, что это оксиды. |
| 3. Этап целеполагания на урок. Цель: создание условий для формирования у обучающихся способности самостоятельно ставить учебные цели на уроке. | Запишем в тетрадях тему урока: «Оксиды» Давайте сформулируем цель нашего урока. Цель: приобретение знаний по теме «Оксиды»: состав, классификация, свойства, получение и применение оксидов. Давайте вместе сформулируем план изучения класса сложных веществ по аналогии с простыми веществами. Понятие – оксиды. Классификация оксидов. Номенклатура оксидов. Физические свойства оксидов. Химические свойства оксидов. Основные способы получения оксидов. Значение оксидов в природе и жизни человека По этому плану мы будем писать конспект урока. Мы уже с оксидами начинали немного знакомиться при изучении темы «Кислород». Попытайтесь дать определение оксидам. Можем предположить, что общая формула всех оксидов: RxOy | «Оксиды». (запись в тетрадях)
Формулируют цель. Записывают план в тетрадь:
(Ответ). Оксиды – это сложные вещества, которые состоят из 2-х химических элементов, один из которых кислород. Обучающиеся называют RxOy |
| 4.Этап «Открытие нового знания» |
| 4.1 Создание проблемной ситуации.
Цель: формирование умения анализировать, определять цели и задачи деятельности, выбирать средства для реализации цели. | - Перед вами перечень веществ, выберите из него оксиды. NH3, CaO, HCl, CO2, H2O, CaCO3, SiO2, NaOH, CuO.
- По каким признакам вы выбрали оксиды? В чем сходство этих химических соединений? - Учитель предлагает правило, по которому даются названия оксидам. Давайте назовем эти оксиды | Название = «Оксид» + название элемента | | Оксида в родительном падеже | Если элемент проявляет постоянную валентность, ее не указываем. Если же проявляет переменную валентность, то она указывается в скобках, римскими цифрами. - Сходство нашли. Теперь посмотрите внимательно и скажите, чем отличаются выбранные вами оксиды? (Ответ). Обратите внимание, что в одних оксидах атом кислорода связан с атомом металла (CaO, CuO), а в других оксидах – с неметаллом (CO2, H2O, SiO2). - Можно сказать, что оксиды делятся на оксиды металлов и оксиды неметаллов. | - Выбирают оксиды.
(Ответ). Наличие кислорода, сложные вещества, состоят из 2-х элементов (бинарные).
Называют оксиды
Предлагают свои версии
|
| 4.2.Классификация оксидов | В зависимости от того, с каким химическим элементом связан кислород, различают – КИСЛОТНЫЕ и ОСНОВНЫЕ оксиды. Но есть еще оксиды, которые называются амфотерные (их изучают позже). З аполняем схему аполняем схему НЕМЕТАЛЛЫ – образуют только кислотные оксиды. МЕТАЛЛЫ – образуют и кислотные и основные оксиды. Для металлов существует правило: Если валентность (свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента) в металлах меньше 4-х, то, как правило, образуются основные оксиды; если валентность больше 4-х – кислотные оксиды. (Пример кислотного оксида для металлов – CrO3 (H2CrO4-хромовая кислота); Mn2O7 (HMnO4 – марганцевая кислота). В зависимости от того, какие химические свойства проявляют оксиды, их называют: СОЛЕОБРАЗУЮЩИМИ – оксиды, которые образуют соли (кислотные, основные, амфотерные) НЕСОЛЕОБРАЗУЮЩИМИ (которые не образуют солей, и не проявляющие кислотных, основных и амфотерных свойств) – (NO (монооксид азота, оксид азота (II)), N2O (оксид азота (I), закись азота), CO, SiO). Запишите в тетрадь несолеобразующие оксиды. | Обучающиеся работают с таблицей.
Записывают в тетрадях классификацию
Записывают в тетрадь несолеобразующие оксиды: (NO (монооксид азота, оксид азота (II)), N2O (оксид азота (I), закись азота), CO, SiO). |
| 4.3. Работа в группах | Сейчас мы разделимся на группы, и каждая группа получит свое задание на карточке (см.Приложение). Раздает карточки с заданиями для каждой группы: Способы получения. Лабораторный опыт «Получение оксида меди путем сжигания медной проволоки» Физические свойства Химические свойства Значение оксидов Теперь представители от группы будут докладывать результаты работы. И мы совместно будем заполнять конспект урока по плану. | Получают свои задания на карточках, работают в группах, отвечая на вопросы при работе с учебником. Затем представитель от группы докладывает результат работы группы. Записывают тезисно результаты каждой группы в конспект. |
| 4.3.1. Способы получения оксидов Проверка знаний техники безопасности Лабораторный опыт (освоение универсальных естественнонаучных способов деятельности: наблюдение, учебное исследование, выявление причинно-следственных связей). | - Как вы думаете, как можно получить оксиды? Посмотрите схему 6 с.134 Оксиды получают двумя способами. -Как нужно потушить спиртовку после работы? -Сейчас мы будем сжигать медную проволоку. Почему проволоку при нагревании необходимо держать щипцами? Описание: медную проволоку скрутить в спираль, закрепить в щипцах и прокалить в пламени спиртовки. Вопросы к опыту: -Что произошло с медной проволокой? - Как вы думаете, почему почернела проволока? - Связано ли наблюдаемое вами явление с кислородом? Запишем уравнение реакции проведенного опыта. 2Cu+O2=2CuO В результате реакции горения простых веществ, продуктом является только оксид. При горении сложных веществ, в результате реакции образуются - оксид и выделяется вода. Запишем примеры получения оксидов: 2C2H2 + 5O2 = 4CO2 + 2H2O 2PH3 + 4O2 = P2O5 + 3H2O | Работают с учебников, озвучивают способы получения. (Ответ). Накрыть колпачком. (Ответ). Чтобы не обжечься.
(Ответ). Почернела. (Ответ). Произошла реакция. (Ответ). Да. Потому что процесс горения поддерживается кислородом.
Записывают уравнения реакции, расставляют коэффициенты. |
Физические свойства оксидов
| - Любые вещества обладают физическими и химическими свойствами. Давайте вспомним, что относится к физическим свойствам? Оксиды могут быть твердыми, жидкими и газообразными веществами, различной окраски, с запахом и без запаха, тяжелее или легче воздуха. В результате опыта с медной проволокой образовался нагар, который твердый по своим свойствам. Вода - оксид, по агрегатному состоянию – жидкая. Если открыть бутылку воды, то мы слышим шипение и видим пузырьки выделяющегося газа – это оксид углерода (углекислый газ). Демонстрация образцов оксидов: SiO2 – кварцевый песок, кремнезём. Очень чистый SiO2 известен в виде минералов горного хрусталя. Окрашенный различными примесями, образует драгоценные и полудрагоценные камни – яшма, аметист, агат. Более 50% земной коры состоит из SiO2. Al2O3 . 2 SiO2 .2Н2О – белая глина, состоящая из оксидов алюминия и кремния. СаО- негашеная известь. Н2О – вода, оксид водорода. СО2 – углекислый газ. Твердый оксид углерода – сухой лед. Для изготовления соды, сахара, газированных напитков, в жидком виде в огнетушителях. | (Ответ). Агрегатное состояние: твердое жидкое и газообразное.
|
Химические свойства оксидов Проверка знаний техники безопасности Лабораторный опыт «Получение медного купороса»
(освоение универсальных естественнонаучных способов деятельности: наблюдение, учебное исследование, выявление причинно-следственных связей).
| Все оксиды, как кислотные, так и основные оксиды обладают разными свойствами. (Объясняю химические свойства, записываем в тетрадь.) Основные оксиды А) взаимодействие с кислотами: CuO + H2SO4 →t CuSO4 + H2O Li2O + 2HNO3 = 2LiNO3 + H2O (получается соль и вода) Б) взаимодействие с водой: Li2O + H2O → 2LiOH CaO + H2O = Ca(OH)2 (получается основание) Кислотные оксиды А) взаимодействие с основаниями: CO2 + Ca(OH)2 → CaCO3↓ + H2O SO3 + 2NaOH = Na2SO4 + H2O (получается соль и вода) Б) взаимодействие с водой: P2O5 + 3H2O →t 2H3PO4 N2O5 + H2O = 2HNO3 (получается кислота) В) Менее летучие кислотные оксиды вытесняют более летучие из их солей: CaCO3 + SiO2 →t CaSiO3 + CO2 3Na2CO3 + P2O5 = 2Na3PO4 + 3CO2 (получается соль и оксид) Взаимодействие оксидов между собой: CaO + CO2 → CaCO3 SiO2 + MgO = MgSiO3 (образуется соль) Проверка знаний техники безопасности Лабораторный опыт Описание: Черный порошок оксида двухвалентной меди CuO и помещают в пробирку. Добавляют немного разбавленной серной кислоты. Для начала реакции одного соприкосновения веществ недостаточно, нужно нагревание. Слегка нагревают пробирку с веществами над пламенем спиртовки, не доводя раствор до кипения. В результате реакции наблюдается постепенное исчезновение черного порошка оксида меди и образование раствора голубого цвета. Молекулярное уравнение реакции имеет вид: CuO + H2SO4 →t CuSO4 + H2O |
|
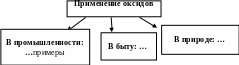
Значение оксидов в природе и жизни человека | Значение оксидов в промышленности и быту, а также для природных процессов - велика. В промышленности: Fe2O3 и Fe3O4 – применяют в производстве чугуна (сплав железа с углеродом) и стали; CaO и SiO2 – производство строительных материалов; CO2 – в пищевой промышленности для производства газированных напитков; H2O – в производственных охладительных системах, для получения новых веществ, в системах орошения, в качестве растворителя и т.д. В быту: H2O – в питьевых и хозяйственных целях; SiO2 – входит в состав чистящих веществ; ZnO –входит в состав белой краски. В природных процессах: H2O и CO2 – обеспечивают осуществление процессов фотосинтеза; H2O – естественный растворитель, составляет основную часть цитоплазмы животных и растительных клеток и т.д. |
|
Этап закрепления изученного материала. Цель: формирование способностей использовать полученные знания
применения полученных знаний на практике
| Базовый уровень В каком из предложенных вариантов приведены формулы только кислотных оксидов.а) SO3, Na2O, CuO б) SO2, CO2, P2O3 в)BaO, Cl2O7, K2O В каком из предложенных вариантов приведены формулы только основных оксидов.а)Br2O7, Li2O, SiO2 б)NO2, Fe2O3, CaO в) CaO, K2O, Li2O Повышенный уровень Составьте формулы названных в тексте оксидов: «В земной коре – литосфере – находятся оксид алюминия (входит в состав глины), оксид кремния (IV) (песок), оксид железа (III)(содержится в красном железняке). Водная оболочка Земли – гидросфера – это оксид водорода. В воздухе есть оксид углерода (IV) (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющую атмосферу: оксид углерода (II) (угарный газ), оксид серы (IV) (сернистый газ), оксид азота (II) и оксид азота (IV)» Распределите вещества по группам |
Работают с учебником Заполняют карточки. Сверяются с ответами, выставляют себе оценки.
Применяют знания на практике. Выполняют задания в тетрадях. Сверяются с ответами, выставляют себе оценки |
Подведение итогов. Рефлексия.
Цель: формирование у обучающихся способности подводить итоги, обобщать, делать выводы, характеризовать свои действия. | Учитель раздает листы самооценки Вспомните, какую цель мы поставили в начале урока? Как вы считаете, достигли ли мы целей? Что нового узнали на уроке? Что было сложным при изучении оксидов? | Обучающиеся анализируют свою деятельность как индивидуальную, так и командную. Оценивают свою работу на уроке. |
Домашнее задание | Диктует домашнее здание: записи в тетради, параграф №40, задание стр.135: №2 (первый столбик), №3; Дополнительно: №4 (а,б,в) | Записывают домашнее задание |
 аполняем схему
аполняем схему