по теме «Типы химических реакций: замещение и обмена».
Способствовать усвоению понятий «реакции замещения», «реакции обмена», научить учащихся писать уравнения реакций замещения и обмена, отличать реакции замещения и обмена среди других типов химических реакций (предметный результат).
Продолжить развивать внимательность, наблюдательность, пытливость, инициативу, выявлять причинно-следственные связи, искать аналогии и работать в команде (метапредметный результат).
Формировать умения управлять своей учебной деятельностью (личностный результат).
| Деятельность учителя | Деятельность учащихся | УУД |
| Этап 1. Организационный |
| - Добрый день, друзья! Мы как всегда рады видеть друг друга и готовы к совместной творческой работе. Психологический настрой (“Все в твоих руках”) . Химическая сказка. | Приветствуют учителя, настраиваются на урок. | Личностные: умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам, осознание возможности личного участия Регулятивные (оценка, саморегуляция) |
| Этап 2. Проверка домашнего задания |
| Предлагает выполнение упражнений по теме «Химические уравнения».
| Выполняют два варианта, обмениваются тетрадями и осуществляют взаимопроверку. | Личностные (самоопределение) Регулятивные (оценка, саморегуляция) Коммуникативные (взаимоконтроль по ходу выполнения заданий) |
| Этап 3. Актуализация знаний |
| Создание проблемной ситуации. На доске: 4Na + O2 = 2Na2O CaCO3 = CaO + CO2↑
Zn + 2HCl = ZnCl2 + H2↑ 2KCl + H2SO4 = K2SO4 + 2HCl ↑ Ребята, посмотрите внимательно на уравнения химических реакций записанные на доске. Что вы о них можете сказать? | Рассказывают о том, сколько веществ было до реакции и сколько веществ образовалось.
| Познавательные (анализ химических реакций с целью выявления отличий) |
| Этап 4. Этап изучения новых знаний и способов деятельности |
| С - Объявляет тему урока, - просит учащихся сформулировать задачи урока.
Создание проблемной ситуации: Демонстрационный эксперимент «Реакция замещения Fe в CuSO4» Демонстрирует опыт.
Примеры реакций замещения. 2 Na + 2 H2O = 2 NaOH + H2 Ba + 2 H2O = Ba(OH)2 + H2 Mg + H2SO4 = MgSO4 + H2 2Al + 6 HCl = 2 AlCl3 + 3 H2 Примеры реакций обмена: MgO + 2 HCl = MgCl2 + H2O HNO3 + NaOH = NaNO3 H2SO4 + 2 KOH = K2SO4 + 2 H2O FeS + 2 HCl = FeCl2 + H2S |
Сравнивают физические свойства вступающего в реакцию вещества и образующихся веществ. Записывают схему реакции сначала словами, а затем через уравнение химической реакции.
Сравнивают физические свойства вступающих в реакцию веществ и образующегося вещества. Записывают схему реакции сначала словами, а затем через уравнение химической реакции.
| Познавательные (постановка и решение проблемы, логические универсальные действия) Коммуникативные (сотрудничество в поиске и сборе информации) Регулятивные ( формирование умения слушать собеседника, проявлять познавательную инициативу в учебном сотрудничестве)
Личностные (смыслообразование)
|
| Этап 5.Первичная проверка понимания изученного материала |
| Беседа с учащимися.
| Заполняют кластер.
| Личностные: умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам, осознание возможности личного участия Познавательные (поиск и выделение необходимой информации и структурирование знаний, анализ объектов с целью выделения признаков) |
| Этап 6. Закрепление изученного материала |
| Вы изучили два типа химических реакций – реакции замещения и обмена, научились расставлять коэффициенты в уравнениях этих реакций. Zn + 2 HCl = ZnCl + H2 Fe + H2O = FeO + H2 FeO + H2SO4 = FeSO4 + H2O NaOH + HCl = NaCl + H2O
| Выполняют задания. В парах проверяют и сообщают учителю результаты
| Познавательные ( анализ объектов с целью выделения признаков) Регулятивные ( формирование умения в сотрудничестве с учителем ставить новые учебные задачи) Коммуникативные (планирование учебного сотрудничества и способов взаимодействия)
|
| Этап 7. Информация о домашнем задании |
| § 30 упр.1- 2 на с. 110
| Ученики выбирают задания по уровням | Личностные: умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам, осознание возможности личного участи.
Регулятивные УУД: Умение организовать выполнение заданий учителя, делать выводы по результатам работы, заданий учителя. |
| Этап 8. Подведение итогов учебного занятия |
| Анализирует работу класса, групп, нацеливает на формулирование выводов по уроку. Выставляет оценки. | Делают вывод о необходимости умения наблюдать, проводить эксперимент, изучать вещества и происходящие с ними явления, об умении делать выводы для познания окружающей природы, о тесной связи происходящих явлений и возможности познания тайн природы для сохранения её и практического применения человеком. | Регулятивные (оценка, саморегуляция) Познавательные (общеучебные универсальные действия, логические универсальные действия)
|
| Этап 9. Рефлексия |
| Учитель инициирует рефлексию (метод пяти пальцев) На листе бумаги обводят левую руку. Каждый палец – это какая-то позиция, по которой надо высказать свое мнение. М (мизинец) - мыслительный процесс: какие знания я сегодня получил Б (безымянный) - близость цели: что я сегодня сделал и чего достиг С (средний) - состояние духа: каким было у меня сегодня настроение У (указательный) – услуга, помощь: чем я сегодня помог другим, чем порадовал или чему способствовал Б (большой) – бодрость, физическая форма: каким было моё самочувствие. Учитель благодарит за урок. | На листе бумаги обводят левую руку, вписывают своё мнение по каждой позиции | Регулятивные (оценка, саморегуляция) Личностные: умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам, осознание возможности личного участи.
|
| Контрольно – измерительный материал | Планируемый результат | Умения, характеризующие достижения этого результата. |
| Этап 2. Актуализация знаний. |
| Ребята, посмотрите внимательно на уравнения химических реакций записанные на доске. 4Na + O2 = 2Na2O CaCO3 = CaO + CO2↑ Zn + 2HCl = ZnCl2 + H2↑ 2KCl + H2SO4 = K2SO4 + 2HCl ↑ Что вы о них можете сказать? | Осуществлять поиск необходимой информации для выполнения учебных заданий. | Умение организовать выполнение заданий учителя, делать выводы по результатам работы. |
| Этап 5.Первичная проверка понимания изученного материала |
|
Заполняют кластер 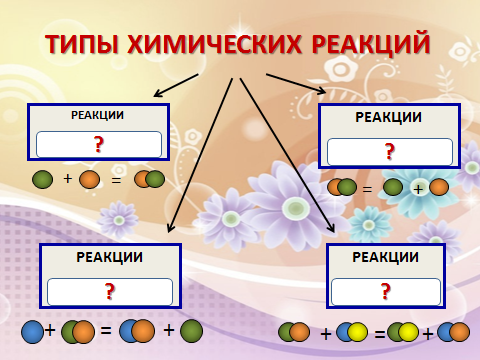
| Осуществлять поиск необходимой информации для выполнения учебных заданий. | Умение организовать выполнение заданий учителя, делать выводы по результатам работы. |
| Этап 6. Закрепление изученного материала |
| Определите реакции замещения и обмена, расставьте коэффициенты в уравнениях этих реакций. Zn + 2 HCl = ZnCl + H2 Fe + H2O = FeO + H2 FeO + H2SO4 = FeSO4 + H2O NaOH + HCl = NaCl + H2O
| Осуществлять поиск необходимой информации для выполнения учебных заданий. | Умение организовать выполнение заданий учителя, делать выводы по результатам работы. |

















