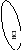Урок « Оксиды» относится к блочной теме « Соединения химических элементов» и является вторым по счету. Занятие носит проблемный характер, построен на применении знаний учащихся о бинарных соединениях и валентности элементов.
Тип урока: урок изучения нового материала
Цель урока: сформировать понятие об оксидах как об одном из классов химических соединений; рассмотреть состав, строение, номенклатуру.
Образовательные задачи:
- дать понятие об оксидах
- продолжить формирование умения составлять формулы веществ, используя валентность элементов, названия веществ.
- закрепить знания химической номенклатуры для бинарных соединений
- показать значение оксидов в природе и жизни человека.
Развивающие задачи:
- Развивать речевые навыки, наблюдение и умение делать выводы
- развивать умение работать коллективно
- Развивать интерес к химической науке
Воспитательные задачи:
- Воспитывать умение работать в атмосфере поиска, творчества, прививать чувство ответственности за выполненную работу, самостоятельность, общительность, коммуникабельность.
Оборудование: ноутбук, проектор, экран, ПСХЭ Д.И. Менделеева, дидактический материал, учебник; на столах учащихся образцы природных минералов и руд, содержащих оксиды.
Ход урока:
- Организационный момент
Приветствие, проверка готовности к уроку. Цель: Включение детей в деятельность на личностно-значимом уровне.
- Актуализация знаний.
Мотивация учебной деятельности на успешную работу. Цель: Повторение изученного материала, необходимого для «открытия нового знания»
Вначале урока учитель проводит самостоятельную работу, где отрабатываются умения учащихся определять валентность химических элементов по формулам бинарных соединений и, наоборот, записывать формулы по валентности.
Самостоятельная работа «Валентность химических элементов»
- Изучение нового материала.
(Цель: формирование системно-информационного анализа, развитие умений определять цели и задачи деятельности, выбирать средства реализации цели)
Класс веществ, который нам предстоит изучить, всегда содержит кислород, представители этого класса получаются при взаимодействии с кислородом, это бинарные соединения.
Выпишите формулы этих соединений. (см. формулы в с/р, один ученик -у доски, остальные в тетрадях)
Al2O3
CaO Какой класс сложных веществ нам предстоит изучить?
CO2 Назовите тему сегодняшнего урока? (учащиеся: оксиды)
- Верно. Вы правильно определили тему сегодняшнего урока «Оксиды. Состав, классификация, номенклатура».
Этап «открытия нового знания»
- Определение класса оксидов
Проанализируйте формулы. Что общего во всех этих веществах?
( Учащиеся выделяют общие признаки оксидов, работая в паре)
- Сформулируем определение оксидов, ответив на 3 вопроса.
а) какие вещества по составу?
б) сколько элементов в составе?
в) какой элемент обязательно входит в состав оксидов, его валентность?
Al2O3 1. Сложные вещества.
CaO 2. Состоят из 2 х.э.
CO2 3. О, II
- Дайте определение оксидам (Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород c валентностью -2).
Первичная проверка усвоения нового материала. Игра «Волшебный цветок» : сорвать все лепестки с формулами оксидов.
(Учащиеся работают в группах, выбирают формулы оксидов, мотивируя свой выбор).
г) Алгоритм составления формул оксидов (учащиеся работают с учебником).
Выведите общую формулу класса оксидов.
II
ЭxОy
Составьте формулы оксидов: оксид бария, оксид алюминия, оксид калия, оксид углерода(IV), оксид серы(VI) , оксид железа(III) Физминутка. Трудным оказался путь, надо бы передохнуть. (Зарядка для глаз)
2) Номенклатура (названия) оксидов.
Алгоритм построения названий оксидов: Оксид + название элемента в родительном падеже (валентность в случае ее переменности)
Первичная проверка усвоения нового материала. 1.Назовите оксиды: К2О, FeO, Fe2O3(работа в группах, самоконтроль по шаблону) 2.Выпишите в столбик из перечня химических формул веществ формулы оксидов и дайте им названия:
MgO, KOH, O3, SO3, SO2, Al2S3, CaCO3, Аl2O3, Mg(OH)2, CO2, Na3N, HCl, CaO, H2CO3, FeCl3, Na2O, СuО, Cu2O, HNO3 ,NH3
3) Многие оксиды встречаются в природе в виде полезных ископаемых, они находятся в окружающем нас воздухе, образуются в результате деятельности человека. Сейчас вы познакомитесь с образцами оксидов. (работа с коллекцией природных оксидов)
4) Составьте формулы названных в тексте оксидов (работа с текстом в группе, самоконтроль по шаблону)
В земной коре – литосфере – находится оксид алюминия ________ (глина), оксид кремния (IV) _____ (песок), оксид железа (III) ______ (содержится в красном железняке). Водная оболочка Земли – гидросфера – оксид водорода _____. В воздухе есть оксид углерода (IV) ______ (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) _____ (угарный газ), оксид серы (IV) ______ (сернистый газ), оксид азота (II) ____ и оксид азота (IV) ______.
IV.Контроль знаний, обратная связь ( самостоятельная работа учащихся, оценка своей работы по ключу)
Тест по теме: «Оксиды».
1.Общая формула оксидов.
А) ЭxОy Б) ЭхНу В) ЭхНуО
2. Ряд формул, в котором все вещества оксиды:
А) ZnO, ZnCl2, H2O Б) CaO, NaOH, NH3 В)SO3, MgO, CuO
3. Оксид марганца (IV) имеет формулу
А)Mn2O7 Б) MnO2 В) MnF4
4. Установите соответствие между формулой оксида и названием
Формула оксида Название оксида
1.NO А) оксид азота (II)
2.N2O3 Б) оксид азота (IV)
3.NO2 В) оксид азота (III)
Г) оксид азота (V)
5. Запишите формулы: оксид натрия, оксид углерода (IV), оксид фосфора (V)
V.Подведение итогов. Рефлексия.
- Цель: формирование у учащихся способности подводить итоги урока, обобщать, делать выводы, характеризовать свои действия)
Сегодня на уроке
- Мне удалось...
- Я узнал(а) много нового …
- Я научился …
- Мне необходимо …
Запишите продолжение этого предложения в тетрадях. Итак, озвучьте свои записи.
Оцените себя.
- Домашнее задание: § 18 упр. 1
Используя дополнительную литературу подготовить сообщение на тему: «Применение оксидов».