Цель урока: обобщить полученные по теме знания, расширить кругозор учащихся, поддерживать интерес к предмету, развивать умения самостоятельно работать с дополнительной литературой.
Задачи урока:
- Образовательные: закрепление первоначальных знаний о строении, свойствах, получении и применении оксидов.
- Воспитательные: формирование умения работать в коллективе, оценивать свои возможности и знания товарищей.
- Развивающие: развитие логического мышления путем сравнения, обобщения, синтеза; развитие познавательной активности и творческой деятельности.
План урока:
- Организационный момент. Постановка целей и задач урока.
- Графический диктант.
- Игра «Крестики - нолики»
- Найди соответствие (задание по номенклатуре оксидов)
- Составь формулы оксидов.
- Игра «Волшебна пирамида».
- Игра «Химическое лото».
- Разгадывание кроссворда «Вокруг кислорода».
- Игра «Химический лабиринт».
10) Мини – тест.
11) Подведение итогов урока.
12) Рефлексия.
13) Домашнее задание: повторить параграфы, составить синквейны со словами «оксид» (1 группа) и «кислород» (2 группа)
Ход урока:
- Организационный момент. Постановка целей и задач урока (слайды 1 - 5)
Слово учителя: Сегодняшний урок по теме «Кислород. Оксиды. Горение » будет необычным. Мы совершим путешествие в королевство Её Величества Реакции Горения. Но это будет не простая прогулка. Вас ждут испытания, преодолеть которые можно только с помощью знаний, полученных на уроках химии.
Итак, в путь – дорогу, друзья!
Эпиграф нашего урока «Куда не глянь – кругом оксиды. Оксидам слава и хвала!»
- Повторение пройденного материала. Графический диктант с последующей взаимопроверкой (слайды 6 - 7).
Слово учителя: Путь в королевство лежит через графический диктант. Вы должны выбрать правильные суждения. Если суждение верное, то следует поставить «+», неверное – «-». Внимание на доску.
1. Формула кислорода – простого вещества О2
2. Кислород в обычных условиях – твердое вещество.
3. Сырьем для промышленного получения кислорода является воздух.
4. Кислород хорошо растворим в воде.
5. Самое распространенное соединения химического элемента кислорода – вода.
6. Воздух – смесь газов.
7. Постоянными компонентами воздуха являются водород, оксид углерода (IV).
8. Оксиды – бинарные соединения.
9. Формула оксида кальция – СаО.
10. Все оксиды образуются при горении веществ.
Слово учителя: Молодцы, ребята! Справились с заданием, но не все. Кое-кто сбился с правильного пути. Нужно вам помочь. Вашему вниманию волшебный цветок, который поможет вам продолжить путешествие в полном составе. На лепестках цветка изображены формулы веществ. Выпишите из них формулы оксидов (слайд 8).
- Слово учителя: Теперь вы опять все вместе. Но вас ждет еще одно испытание. Чтобы открылась невидимая дверь в Королевство, мы должны сыграть в игру «Крестики - нолики». Выигрышный путь составляют формулы оксидов (слайд 9).
А)
HNO3 SO2 SO3 Б)
CO2 CuO MgO KClO3 ZnO Na2O
O2 NaOH ZnSO4 NaOH SO3 H2SO4
- 2 N2O3 CO2
(Ученики записывают задание в рабочие тетради и выполняют, 2 ученика выполняют задание у доски).
- Найди соответствие (слайд 10).
Слово учителя: Каждого человек при рождении получает имя. «Имена» есть и у оксидов. Ваша задача - установить соответствие между «именем» оксида и его химической формулой (соединить название оксида с его формулой стрелкой).
Оксид серы (VI) P2O5 диоксид углерода
Оксид фосфора (V) CO2 триоксид дижелеза
Оксид железа (III) SO3 монооксид дикалия
Оксид меди (II) Fe2O3 триоксид серы
Оксид углерода (IV) K2O монооксид меди
Оксид калия (I) CuO пентаоксид дифосфора
- Составь формулы оксидов (слайд 11).
Слово учителя: следующее задание, которое предстоит вам выполнить по пути следования, также связано с оксидами. Из предложенных на экране карточек, вы должны составить формулы оксидов с учетом валентности элемента.
Ответы: CaO, SO2, Al2O3, NO, NO2, Fe2O3, MgO, SO3.
- Игра «Волшебная пирамида» (слайд 12).
Слово учителя: из курса истории вам должно быть известно, что одним из чудес света является пирамида Хеопса. Но наша пирамида будет состоят из оксидообразующих «кирпичиков».
Задание: Составь формулы всех возможных оксидов, комбинируя «кирпичики». Оксидообразующие «кирпичики» должны стоять рядом. Можно двигать сверху вниз и слева направо. Число всех оксидов равно относительной атомной массе углерода.
- Игра «Химическое лото» (слайды 13 - 14).
Расставьте все карточки на игральную доску, так чтобы цифры в клетках доски соответствовали валентности химического элемента, образующего данный оксид.
- Разгадывание кроссворда «Вокруг кислорода» (слайд 15).
- Игра «Химический лабиринт» (слайд 16).
10) Мини – тест на закрепление (слайд 17 и 18)
11) Подведение итогов урока.
Просмотр содержимого документа
«панорамный урок оксиды»
Родниковская средняя школа
Урок – обобщение по теме
«Кислород. Оксиды. Горение»
8 класс
учитель: Кинжатова Р.Е.
Родниковская средняя школа
2015 год
Цель урока: обобщить полученные по теме знания, расширить кругозор учащихся, поддерживать интерес к предмету, развивать умения самостоятельно работать с дополнительной литературой.
Задачи урока:
Образовательные: закрепление первоначальных знаний о строении, свойствах, получении и применении оксидов.
Воспитательные: формирование умения работать в коллективе, оценивать свои возможности и знания товарищей.
Развивающие: развитие логического мышления путем сравнения, обобщения, синтеза; развитие познавательной активности и творческой деятельности.
План урока:
Организационный момент. Постановка целей и задач урока.
Графический диктант.
Игра «Крестики - нолики»
Найди соответствие (задание по номенклатуре оксидов)
Составь формулы оксидов.
Игра «Волшебна пирамида».
Игра «Химическое лото».
Разгадывание кроссворда «Вокруг кислорода».
9) Игра «Химический лабиринт».
10) Мини – тест.
11) Подведение итогов урока.
12) Рефлексия.
13) Домашнее задание: повторить параграфы, составить синквейны со словами «оксид» (1 группа) и «кислород» (2 группа)
Ход урока:
Организационный момент. Постановка целей и задач урока (слайды 1 - 5)
Слово учителя: Сегодняшний урок по теме «Кислород. Оксиды. Горение » будет необычным. Мы совершим путешествие в королевство Её Величества Реакции Горения. Но это будет не простая прогулка. Вас ждут испытания, преодолеть которые можно только с помощью знаний, полученных на уроках химии.
Итак, в путь – дорогу, друзья!
Эпиграф нашего урока «Куда не глянь – кругом оксиды. Оксидам слава и хвала!»
Повторение пройденного материала. Графический диктант с последующей взаимопроверкой (слайды 6 - 7).
Слово учителя: Путь в королевство лежит через графический диктант. Вы должны выбрать правильные суждения. Если суждение верное, то следует поставить «+», неверное – «-». Внимание на доску.
1. Формула кислорода – простого вещества О2
2. Кислород в обычных условиях – твердое вещество.
3. Сырьем для промышленного получения кислорода является воздух.
4. Кислород хорошо растворим в воде.
5. Самое распространенное соединения химического элемента кислорода – вода.
6. Воздух – смесь газов.
7. Постоянными компонентами воздуха являются водород, оксид углерода (IV).
8. Оксиды – бинарные соединения.
9. Формула оксида кальция – СаО.
10. Все оксиды образуются при горении веществ.
Слово учителя: Молодцы, ребята! Справились с заданием, но не все. Кое-кто сбился с правильного пути. Нужно вам помочь. Вашему вниманию волшебный цветок, который поможет вам продолжить путешествие в полном составе. На лепестках цветка изображены формулы веществ. Выпишите из них формулы оксидов (слайд 8).

Слово учителя: Теперь вы опять все вместе. Но вас ждет еще одно испытание. Чтобы открылась невидимая дверь в Королевство, мы должны сыграть в игру «Крестики - нолики». Выигрышный путь составляют формулы оксидов (слайд 9).
![]()
А)




HNO3 SO2 SO3 Б)


CO2 CuO MgO KClO3 ZnO Na2O
![]()
O2 NaOH ZnSO4 NaOH SO3 H2SO4
Cu(OH)2 N2O3 CO2
(Ученики записывают задание в рабочие тетради и выполняют, 2 ученика выполняют задание у доски).
Найди соответствие (слайд 10).
Слово учителя: Каждого человек при рождении получает имя. «Имена» есть и у оксидов. Ваша задача - установить соответствие между «именем» оксида и его химической формулой (соединить название оксида с его формулой стрелкой).
Оксид серы (VI) P2O5 диоксид углерода
Оксид фосфора (V) CO2 триоксид дижелеза
Оксид железа (III) SO3 монооксид дикалия
Оксид меди (II) Fe2O3 триоксид серы
Оксид углерода (IV) K2O монооксид меди
Оксид калия (I) CuO пентаоксид дифосфора
Составь формулы оксидов (слайд 11).
Слово учителя: следующее задание, которое предстоит вам выполнить по пути следования, также связано с оксидами. Из предложенных на экране карточек, вы должны составить формулы оксидов с учетом валентности элемента.
Ответы: CaO, SO2, Al2O3, NO, NO2, Fe2O3, MgO, SO3.
Игра «Волшебная пирамида» (слайд 12).
Слово учителя: из курса истории вам должно быть известно, что одним из чудес света является пирамида Хеопса. Но наша пирамида будет состоят из оксидообразующих «кирпичиков».
Задание: Составь формулы всех возможных оксидов, комбинируя «кирпичики». Оксидообразующие «кирпичики» должны стоять рядом. Можно двигать сверху вниз и слева направо. Число всех оксидов равно относительной атомной массе углерода.
Игра «Химическое лото» (слайды 13 - 14).
Расставьте все карточки на игральную доску, так чтобы цифры в клетках доски соответствовали валентности химического элемента, образующего данный оксид.
Разгадывание кроссворда «Вокруг кислорода» (слайд 15).
Игра «Химический лабиринт» (слайд 16).
10) Мини – тест на закрепление (слайд 17 и 18)
11) Подведение итогов урока.
4
Просмотр содержимого презентации
«слайды панорамный урок оксиды»

Кислород. Оксиды. Горение. (урок -общение)

- Образовательные — закрепление первоначальных знаний о строении, свойствах, получении и применении оксидов.
- Воспитательные — формирование умения работать в коллективе, оценивать свои возможности и знания товарищей.
- Развивающие — развитие логического мышления путем сравнения, обобщения, синтеза; развитие познавательной активности и творческой деятельности.

Загадка
Их получают путем горения Или сложных веществ разложения. В них два элемента, один – кислород. Я отнесу к ним известь, и лед. Какие это вещества?

Эпиграф урока:
“ Куда не глянь – Кругом оксиды. Оксидам слава и хвала!”

- П л а н у р о к а
- 1. Организационный момент. Постановка целей и задач урока.
- 2. Графический диктант.
- 3. Игра «Крестики - нолики»
- 4. Найди соответствие (задание по номенклатуре оксидов)
- 5. Составь формулы оксидов.
6. Игра «Волшебна пирамида».
- 7. Игра «Химическое лото».
- 8. Разгадывание кроссворда «Вокруг кислорода».
- 9. Игра «Химический лабиринт».
- 10 Мини – тест.
- 11. Подведение итогов.

I. Повторение пройденного материала (графический диктант):
1. Формула кислорода – простого вещества О 2
2. Кислород в обычных условиях – твердое вещество.
3. Сырьем для промышленного получения кислорода является воздух.
4. Кислород хорошо растворим в воде.
5. Самое распространенное соединения химического элемента кислорода – вода.
6. Воздух – смесь газов.
7. Постоянными компонентами воздуха являются водород, оксид углерода (IV).
8. Оксиды – бинарные соединения.
9. Формула оксида кальция – СаО.
10. Все оксиды образуются при горении веществ.
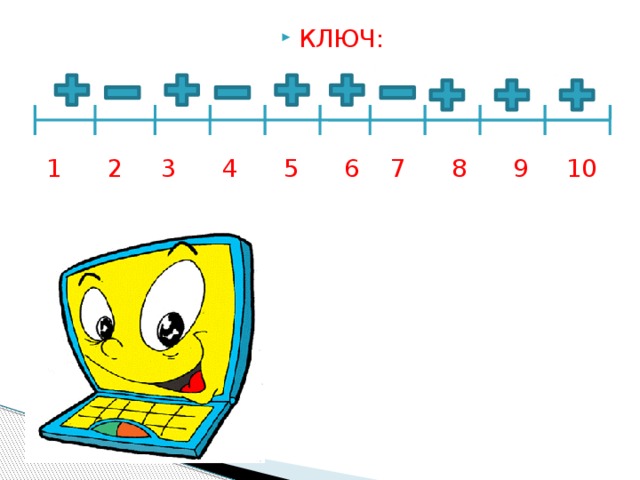
1 2 3 4 5 6 7 8 9 10

P 2 O 5
SO 2
KOH
K 2 O
K 2 SO 4
FeO
CO 2
H 2 CO 3
H 2 SO 4
HCl
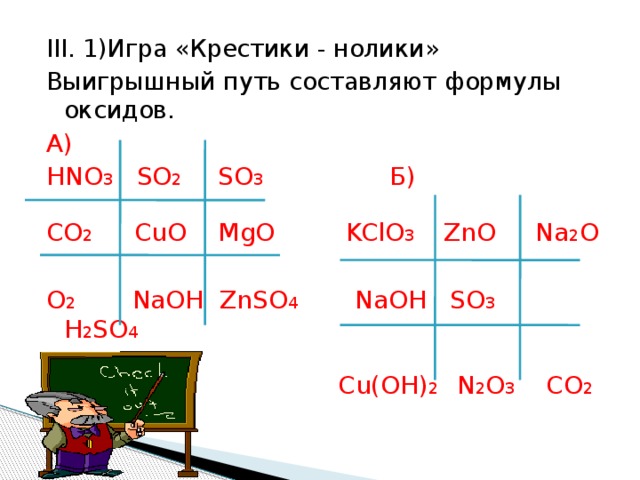
III. 1)Игра «Крестики - нолики»
Выигрышный путь составляют формулы оксидов.
А)
HNO 3 SO 2 SO 3 Б)
CO 2 CuO MgO KClO 3 ZnO Na 2 O
O 2 NaOH ZnSO 4 NaOH SO 3 H 2 SO 4
Cu(OH) 2 N 2 O 3 CO 2

2)Найди соответствие между формулами веществ и их названиями:
Оксид серы (VI) P 2 O 5 диоксид углерода
Оксид фосфора (V) CO 2 триоксид дижелеза
Оксид железа (III) SO 3 монооксид дикалия
Оксид меди (II) Fe 2 O 3 триоксид серы
Оксид углерода (IV) K 2 O монооксид меди
Оксид калия (I) CuO пентаоксид
дифосфора
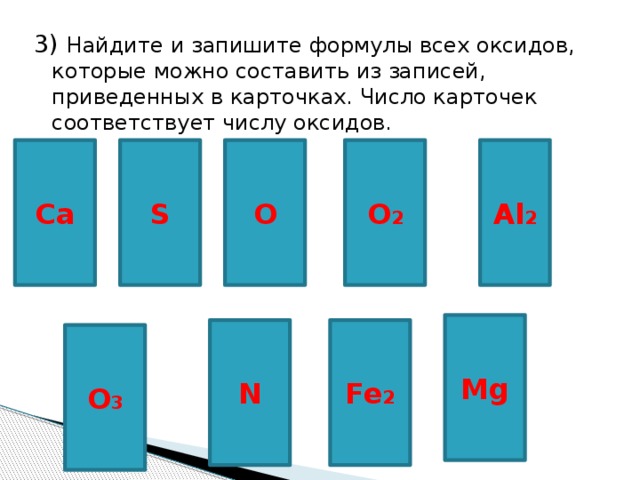
3) Найдите и запишите формулы всех оксидов, которые можно составить из записей, приведенных в карточках. Число карточек соответствует числу оксидов.
Ca
S
O
Al 2
O 2
Mg
Fe 2
N
O 3
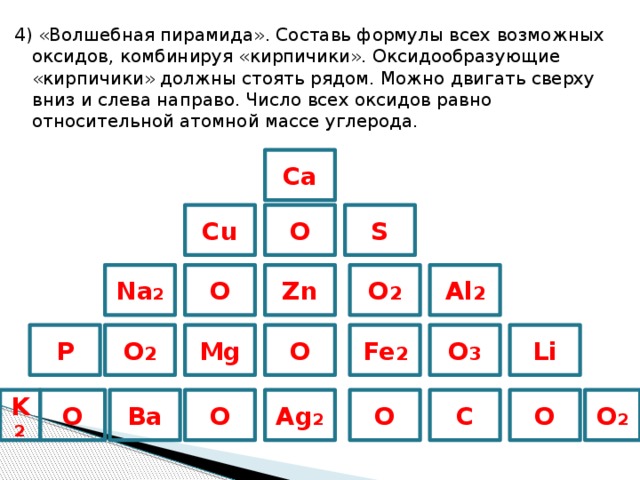
4) «Волшебная пирамида». Составь формулы всех возможных оксидов, комбинируя «кирпичики». Оксидообразующие «кирпичики» должны стоять рядом. Можно двигать сверху вниз и слева направо. Число всех оксидов равно относительной атомной массе углерода.
Ca
O
S
Cu
Na 2
Zn
O
Al 2
O 2
P
Mg
O 2
Li
Fe 2
O 3
O
Ag 2
C
O
O 2
O
O
Ba
O
K 2

5) Игра «Химическое лото». Расставьте все карточки на игральную доску, так чтобы цифры в клетках доски соответствовали валентности химического элемента, образующего данный оксид.
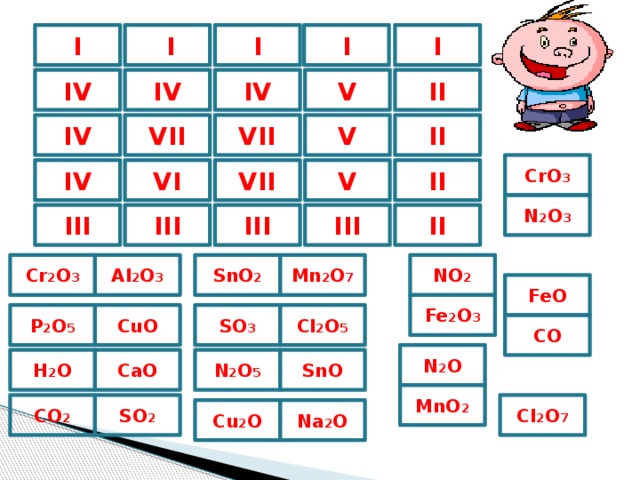
I
I I
I
I
I
IV
IV
V
II
IV
IV
VII
VII
V
II
CrO 3
II
VI
VII
V
IV
N 2 O 3
III
III
III
III
II
NO 2
Mn 2 O 7
Cr 2 O 3
Al 2 O 3
SnO 2
FeO
Fe 2 O 3
CuO
Cl 2 O 5
P 2 O 5
SO 3
CO
N 2 O
N 2 O 5
SnO
H 2 O
CaO
MnO 2
CO 2
SO 2
Cl 2 O 7
Cu 2 O
Na 2 O

Кроссворд «Вокруг кислорода»
- По горизонтали: 1. Вещества, которые получаются при горении разных веществ в кислороде. 3. Английский химик, открывший кислород. 4. Вещество, поддерживающее горение и дыхание. 5. Тип химических реакций, в результате которых получают кислород. 6. Простое вещество, при горении которого в кислороде образуется белое твердое вещество. 7. Процесс с участием кислорода, сопровождающийся выделением теплоты и света. 8. Тип реакции S + O 2 = SO 2 . 9. Соединение кислорода, необходимое для процессов жизнедеятельности.
- По вертикали: 2. Самый распространенный химический элемент в земной коре.
Оксиды азота вызывают загрязнения воздуха
В кислороде вещества горят быстрее
Содержание СО 2 в воздухе всегда постоянно
Катализаторы изменяют
Оксиликвиты горят
скорость реакции
медленно
- + + +
+ - - - - - +
+ + - -
- - + + + -
-
- + - +
+ + + - + -
+ +
- - - + - + - - - +
- + +
+
При горении простых веществ образуются оксиды
При горении веществ в кислороде высвобождается теплота
Фотосинтез – процесс связывания кислорода
Вырубка леса приводит к снижению содержания кислорода
Содержание благородных газов в воздухе всегда постоянно
Содержание азота в воздухе всегда постоянно
При горении сложных веществ образуются оксиды
При реакциях замещения образуются оксиды
Р 2 О 5 – белое твердое вещество
Содержание водяного пара в воздухе всегда постоянно
Наличие кислорода – необходимое условие жизни всех организмов
Все оксиды неметаллов реагируют с водой
Не все оксиды растворимы в воде
Оксиды металлов – основные оксиды
При разложении сложных веществ могут образоваться оксиды
Финиш!
Все оксиды неметаллов растворяются в воде
Оксид натрия – основной оксид
Для горения топлива всегда нужен кислород
Все простые вещества реагируют с кислородом
Кислород – самый распространен-ный элемент на Земле

Мини – тест (ответить «да» или «нет»)
1.Химический элемент кислород образует простые и сложные вещества.
2. В промышленности кислород получают из воды.
3. Кислород в воде растворим.
4. При горении топлива образуется оксид углерода (IV).
5. Формула оксида алюминия AlO.
6. Из простых веществ оксиды образуются в результате реакции соединения.
7. Кислород открыл Ломоносов.
8. Основными источниками загрязнения воздуха являются животные и растения.
9. Кислород используют для сварки металлов.
10. Кислород необходим для большинства живых организмов.

Ответы:
1. ДА
2. НЕТ
3. ДА
4. ДА
5.НЕТ
6.ДА
7.НЕТ
8.НЕТ
9.ДА
10.ДА








































