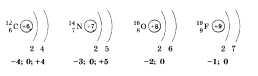
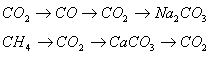Дата: 21 февраля 10 класс
Та?ырып:
Тема: «Общая характеристика неметаллов. Элементы І\/ А группы. ».
О?ыту мен т?рбиелеуді? міндеттері: Учебно – воспитательные задачи:
1. Изучить положение неметаллов в периодической системе химических элементов и их строение.
2.развить навыки написания уравнений реакций (полных и сокращенных ионных), само- и взаимоконтроля, взаимопомощи;
3.научиться работать на доверии, следить за временем, сравнивать результат своей работы с поставленными целями.
Ма?сат:
Цель: Сформировать знания о положении неметаллов в периодической системе химических элементов и их строении
??рал – жабды?тар, к?рнекті ??ралдар: Оборудование, наглядные пособия:
периодическая система химических элементов
Саба? т?рі:
Тип урока: изучение нового материала
?діс-т?сілдер:
Методы: групповая работа, словесно – наглядные.
Саба? барысы:
Ход урока:
Работа над ошибками.
Изуч ение нового материала
Следует начать с характеристики положения неметаллов в периодической системе: если провести воображаемую диагональ от бериллия Be к астату At, то неметаллы расположатся в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Далее важно отметить, что для общей характеристики неметаллов необходимо обратить внимание на строение их атомов, на то, как распределяются электроны по электронным слоям и сколько электронов приходится на внешний электронный слой. Можно привести строение атомов углерода С, азота N, кислорода О, фтора F. Это позволит сделать вывод о том, что по мере увеличения порядковых номеров атомов элементов и накопления электронов на внешнем слое у неметаллов одного периода усиливается способность принимать электроны от других атомов на свой внешний слой, т. е. неметаллические свойства элементов в периодах увеличиваются.
Рассматривая изменение свойств неметаллов при движении по группе, следует отметить, что они ослабевают. Это связано с увеличением расстояния от ядра до внешнего слоя, а следовательно, уменьшением способности ядра притягивать к себе электроны от других атомов. Для подтверждения этого вывода рассмотрим VI группу. В начале ее расположен кислород О — типичный неметалл, а заканчивается группа полонием Ро, обладающим свойствами металла.
Далее следует перейти к рассмотрению физических свойств неметаллов. Следует отметить, что простые вещества — неметаллы могут иметь как атомное (Si, В), так и молекулярное (Н2, N2, Br2) строение. Поэтому среди неметаллов есть газы (О2, С12), жидкости (Вг2), твердые вещества (С, 12). Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
Переходя к характеристике химических свойств, необходимо отметить, что более типичным для неметаллов является процесс принятия электронов. В этом отличие химических свойств неметаллов от химических свойств металлов. Это положение можно подтвердить взаимодействием неметаллов с простыми веществами. При этом следует записать уравнения соответствующих химических реакций и объяснить их сущность с точки зрения процессов окисления — восстановления. Следует отметить, что неметаллы могут проявлять свойства как окислителей, так и восстановителей. :
УГЛЕРОД, КРЕМНИЙ И ЭЛЕМЕНТЫ IV-A ПОДГРУППЫ.
В подгруппу углерода входит элементы: углерод, кремний, германий, олово, свинец
НАХОЖДЕНИЕ В ПРИРОДЕ
Содержание в земной коре: углерод - 0,087%, кремний - 25,8%, германий - 0,00056%, олово - 0,0035%, свинец - 0,0018%
Физические свойства элементов подгруппы углерода.
Элемент
Углерод
C
Кремний
Si
Германий
Ge
Олово
Sn
Свинец
Pb
Свойство
Порядковый номер элемента
6
14
32
50
82
Относительная атомная масса
12,011
28,086
72,61
118,711
207,2
Температура плавления,С0
3850
1423
959
232
327
Плотность г/см3
3,51
2,22
2,33
5,35
7,28
11,34
Степени окисления
+4, +2, -4
+4, +2, -4
+4, +2
+4, +2
+1, +3
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ УГЛЕРОДА.
алмаз
графит
карбин
фуллерит
sp3-гибридизация, тетраэдрические -связи прочные, ковалентные, поэтому очень твердый
sp2-гибридизация, слоистая структура, большое расстояние и непрочные связи между слоями, поэтому мягкий
sp-гибридизация
линейный полимер, твердое вещество
состоит из фуллеренов С60, С70, имеющих форму сферы. Растворим в органических растворителях. Получают при испарении графита в атмосфере гелия.
Получение углерода и кремния
углерод
кремний
Получают нагреванием без доступа воздуха из древесины и каменног угля, а также при крекинге метана:
CH4=C+2H2
SiO2+C=Si+2CO
SiH4=Si+2H2
2Mg+SiO2=2MgO+Si
Химические свойства углерода и кремния.
углерода
кремния
восстановитель
1.C+O2=CO2-ниже 500 0С
2.С+H2O=CO+H2-выше 1200 0С
3.CuO+C=Cu+CO-при нагревании
4.4HNO3+3C=3CO2+4NO+2H2O
окислитель
Ca+2C=CaC2 карбид кальция
2H2+C=CH4
восстановитель
1.Si+2F2=SiF4
2.Si+O2=SiO2
3.Si+Cl2=SiCl4
4.Si+2NaOH+H2O=Na2SiO3+2H2-нагрев.
5.Si+C=SiC
6.2N2+3Si=Si3N4 (> 1000 0C)
окислитель
2Ca+Si=Ca2Si силицид кальция
Соединения углерода и кремния.
углерода
кремния
1.Углеводороды(CH4, C2H2, C6H6 и др.)
2.Карбиды
а)металлического характера
Fe3C
б)ионные карбиды
Al4C3, CaC2 и др.
3)оксиды углерода(II) и (III)
4)соли угольной кислоты-карбонаты
1.Оксид кремния
2.Соли кремниевой кислоты-силикаты
3.Цементы:
обычный( CaO, SiO2)
CaO · SiO2+CO2+H2O=CaCO3+H2SiO3
портланд-цемент (смесь Ca3SiO5, Ca2SiO4, Ca3(AlO3)2)
Ca3SiO5+H2O=Ca2SiO4+Ca(OH)2
Ca2SiO4+4H2O=Ca2SiO4 · 4H2O
Ca3(AlO3)2+6H2O=Ca3(AlO3)2
4.Стекло
Закрепление Задания для самоконтроля
1.Какие из приведенных веществ являются неметаллами: Be, C, Ne, Pt, Si, Sn, Se, Cs, Sc, Ar, Ra?
2.Приведите примеры неметаллов, при обычных условиях представляющих собой а) газы, б) жидкости, в) твердые вещества.
3.Приведите примеры а) молекулярных и б) немолекулярных простых веществ.
В тетрадях написать уравнения химических реакций к одной из двух цепочек превращений (по выбору):
Рефлексия. Вернитесь к целям урока. Достигли ли вы их в ходе работы? Оцените свою работу по направлениям: «я», «мы», «дело».
?йге тапсырма беру:
Задание на дом: стр. 211-215 Запись в тетради. №3-,6. стр.215