Юдакова Татьяна Николаевна, учитель химии и биологии МОУ Тумская СОШ № 46 Клепиковского района Рязанской области
Конспект урока по химии в 8 классе по теме «КИСЛОТЫ»
(Учебник - Химия 8 Г.Е Рудзитиса, Ф.Г. Фельдмана)
Цель: сформировать у учащихся представление о классе кислот.
Образовательные задачи:
Дать представление о строении кислот, их классификации.
Рассмотреть номенклатуру кислот.
Показать значение кислот в жизни человека, их практическое применение.
Совершенствовать химический язык, путём введения новых терминов.
Развивающие задачи:
Совершенствовать практические умения и навыки работы с лабораторным оборудованием и химическими реактивами;
развивать умения наблюдать, сравнивать, анализировать, делать выводы.
Развивать интерес к предмету, используя различные методы и средства обучения.
Развивать умение использовать химическую терминологию.
Развивать мыслительные операции.
Совершенствовать навыки само – и взаимопроверки.
Воспитательные задачи:
воспитание требовательности к себе, умения оценивать результаты своего труда, положительного отношения к знаниям.
Тип урока: урок формирования новых знаний.
Форма урока: комбинированный урок.
Методы и методические приемы: объяснительно-иллюстративные (рассказ с элементами беседы, демонстрация презентации), создание проблемной ситуации, лабораторная работа.
Оборудование: пробирки – 4 штуки, стаканы – 4 штуки; компьютер, мультимедийный проектор, презентация, интерактивная доска с проектором, карточки индивидуальные, 2 вида эталонов ответов,
Вещества: HCl, НNO3, Н2SO4, Н3 PO4, вода, индикаторы
Ход урока
I. Организационный момент.
II. Мотивационный этап. Проверка домашнего задания
Сегодня мы совершим путешествие в Сказочное химическое королевство. С некоторыми жителями мы уже познакомились. С какими.
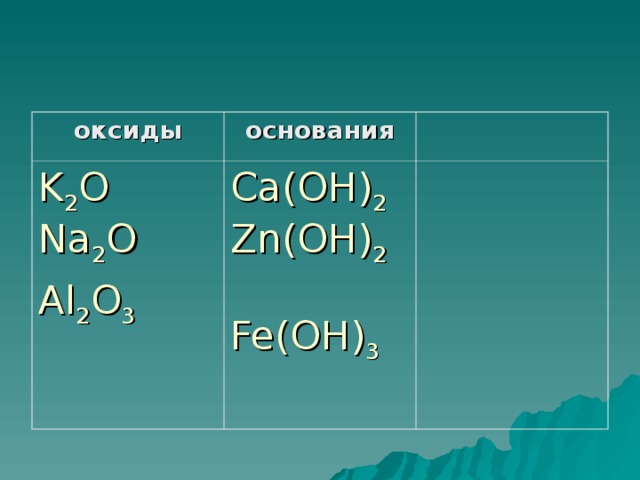
(Оксиды) . Какие вещества называются оксидами?(Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород)
- А почему дом трехэтажный? (На верхнем этаже живут основные оксиды, на втором кислотный, а на первом амфотерные). Приведите примеры.
(Основания) Какие вещества называются основаниями? ( Основания - это соединения, состоящие из атомов металла и одного или нескольких гидроксид-ионов (групп) OH-
- А здесь почему дом двухэтажный? (Растворимые и нерастворимые).
- А как по - другому называют растворимые основания (щелочи) Приведите примеры.
- С жителями дома № 3 мы познакомимся сегодня
Индивидуальные задания:
- Двое выполняет самостоятельную работу. Записать формулы: Оксид магния – , Оксид серы (IV) - , гидрокид алюминия - , гидрокид калия - , (Проверка по эталонам ответа, самопроверка)
-один проводит опыт по определению кислоты, оксида и основания,
- Все остальные покажут генетическую связь между этими тремя домами. Один у доски осуществляет превращение, все остальные вместе с ним в своихтетрадях.
Са à СаО àСа(ОН)2 àСаСl2.
2Са +О2 à 2СаО. СаО +Н2ОàСа(ОН)2. Са(ОН)2 + 2НСl àСаСl2 + Н2О
-Ребята, по результатам исследования была подготовлена презентацию «К чему приводит избыток соляной кислоты в организме человека». Продемонстрирует ее нам …(Мне часто приходилось слышать высказывание: «Я сегодня поела и у меня изжога». Отчего же она происходит, задумалась я. И вот после изучения темы «Кислоты» побеседовала с учителем биологии, учителем химии, с медработником и вот, что я выяснила:… )
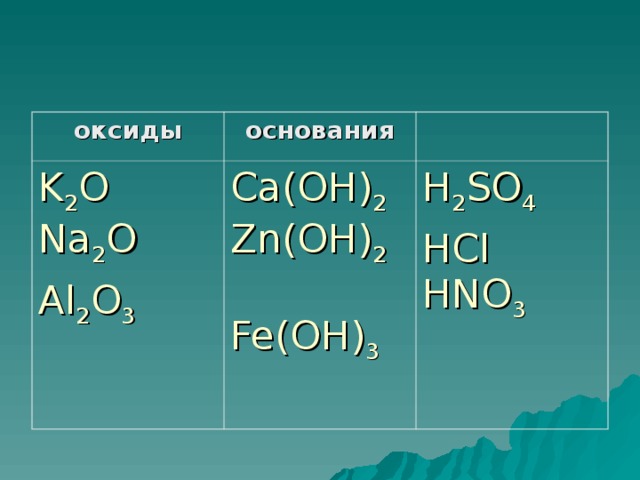
- В нашей лаборатории расцвёл цветок необычайной красоты – на его лепестках – формулы веществ. Расклассифицируйте вещества по классам: Оксиды, основания. В2O3, NaOH, HCI, CаO, H3 РO3, Са(OH )2, MgO, H2 SO4, NaOН, СO2,. Проверим, у кого так же как у… ? У кого по-другому?
-По каким признакам классифицировали?
III. Изучение нового материала.
Постановка цели и задачи.
- Среди приведенных формул есть вещества, которые вы не отнесли ни к одному классу. Это жители нашего следующего дома. Вот с ними-то мы сегодня и познакомимся.
- Вспомните, как классифицируют неорганические соединения. Какие классы мы еще не изучили? Вы пробовали на вкус аскорбинку, яблоко, лимон ? Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку – яблочная кислота, скисшему молоку – молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты. Они представляют собой жидкости или твердые вещества. Растворы их имеют кислый вкус, разъедают растительные и животные ткани. Большинство из них имеют в своем составе кислород. О каких веществах идет речь? Правильно, это кислоты. Какая же тема нашего сегодняшнего урока? Запишем тему.
Для раскрытия темы урока сформулируем цели нашего урока
- освоить знания о … составе, строении, классификации, свойствах, применении солей,
- выработать умения … составлять формулы солей, давать им названия, записывать химические реакции,
-освоить алгоритм … составления формул веществ, записи химических реакций.
- вырабатывать умения… применять алгоритм на практике.
С чего же мы начнем знакомство с новыми веществами? (Будем знакомится со строением, номенклатурой, дадим определение солям)
- Итак, вернемся к оставшимся формулам. Что общего в их строении? Как бы вы сформулировали определение, что такое кислоты? Сравним определение, которое вы дали с определением в учебнике на стр.106.
Номенклатура.
Прочитайте определение запишите в тетрадь
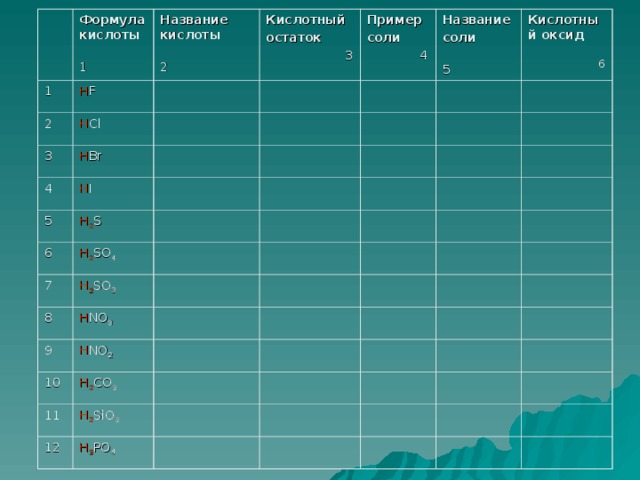
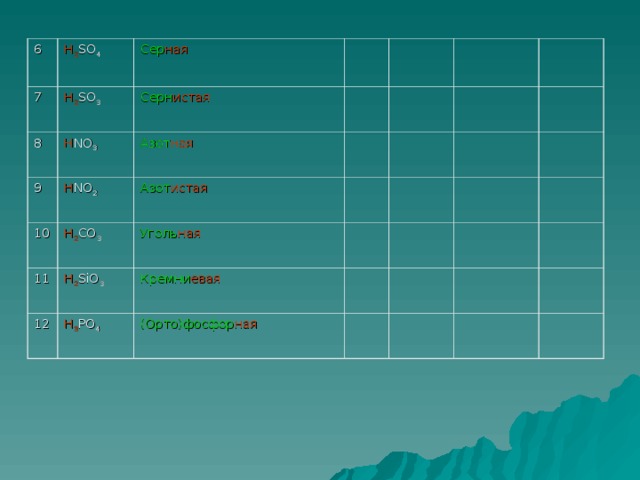
Прочитайте названия и формулы кислот на экране.( дети читают вслух и записывают в тетрадь)
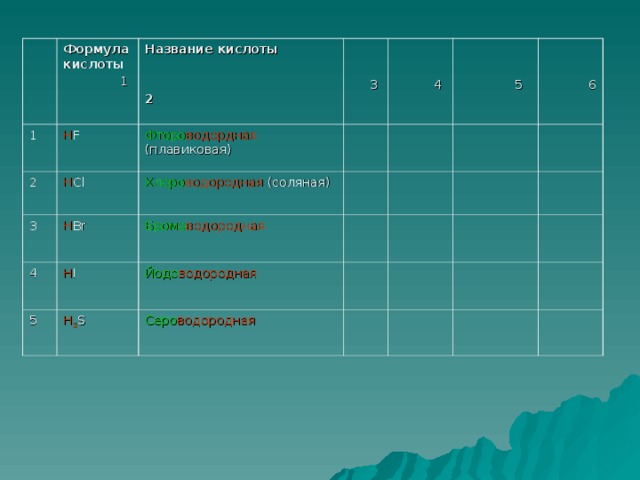
(HCl хлороводородная(соляная)кислота
HF фтороводородная( плавиковая) кислота
HI иодоводородная кислота
HBr бромоводородная кислота
HNO2 азотистая кислота
HNO3 азотная кислота
H2 S сероводородная кислота
H2 SO3 сернистая кислота
H2 SO4 серная кислота
H2 CO3 угольная кислота
H2 SiO3 кремниевая кислота
H3 PO4 фосфорная кислота
4.Классификация кислот
Обратите внимание на формулы кислот.
Состав кислотных остатков различен: в одни входит кислород, в другие не входит, различно содержание атомов водорода
Классификация кислот ( слайд № 7)
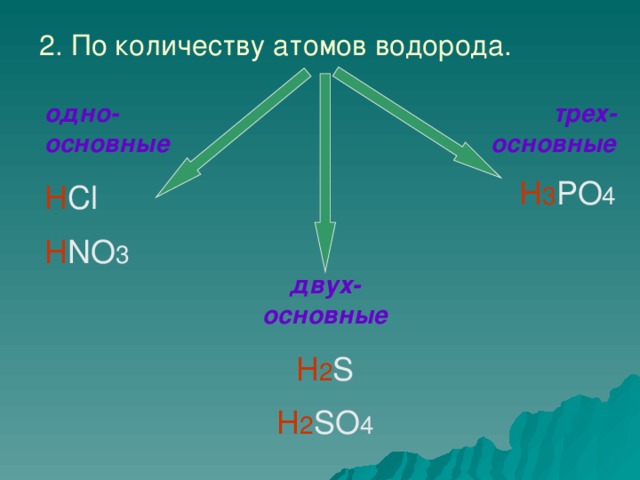
по числу атомов водорода
1.одноосновные (HCl, HNO3)
2. двухосновные (H2 S, H2 SO4, H2 CO3)
3.трехосновные (H3 PO4)
Второй признак классификации кислот по наличию атомов водорода. Различают кислоты одноосновные , двухосновные ,трехосновные (слайд № 8)
Классификация кислот ( слайд №8)
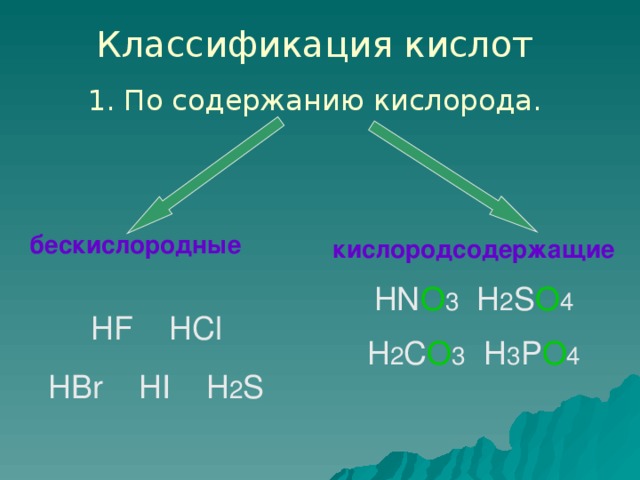
по наличию кислорода
1. бескислородные (HCl, H2 S)
2.кислородсодержащие (HNO3 , H2 SO4, H2 CO3, H3 PO4)
Классификация кислот
по растворимости ( по таблице растворимости определяются кислоты растворимые в воде и нерастворимые)
нерасворимая кислота- кремниевая H2 SO3
Кислоты, которые не существуют
H2CO3=CO2↑ + H2 O
H2 SO3= S O2↑ +H2 O
А теперь попробуем записать формулы по алгоритму.
АЛГОРИТМ
Записываем ионы кислот, из которых состоит соединение.
Определяем заряды ионов.
Находим наименьшее общее кратное для зарядов ионов.
Делим наименьшее общее кратное на заряды ионов. Получаем индексы
Составляем химическую формулу, вписывая индексы.
Лабораторная работа «Знакомство с физическими свойствами солей» Выдаются образцы солей.
IV. Рефлексия. Оценки за урок IV.Закрепление
а) Дан текст, в котором «спрятаны» формулы кислот. Выпишите их.
H2OSOHBrNa2CО3MgBSO4KOH
H3PO4P2O5CaH2SKPHNH3O3C
HClBaSHKSHH2Na2OHClH2SO4
б) В каждом ряду найдите лишнюю формулу, ответ мотивируйте: (слайд №11)
1. H3 PO4 H2 SO4 HCl
2. H2 SO4, H2 CO3, H3 PO4
в) Дайте характеристику следующим кислотам HCl, HNO3, H2 SiO3
по плану: (слайд №12)
1.наличие кислорода
2.основность
3.растворимость
4.степени окисления элементов, образующих кислоту
5.заряд иона, образуемого кислотным остатком
6.соответствующий оксид
Химические свойства
- Что сегодня узнали нового на уроке?
-Что такое кислоты?
- Как они классифицируются?
-Хорошо ли соли растворяются в воде?
Тестирование
Из предложенных вариантов ответов, выберите только один правильный.
1. Выберите ряд веществ, образованный только кислотами:
1) NaCl, Na2 SO4, NaOH 3)Н2СO3, H2 SO4, Н3РO4
2) Cu(NO3)2, CuO, CuCl2 4) ZnCl2, ZnSO4, Zn(NO3)2.
2. Вещество, формула которого Н2CO3, называется:
1) соляная кислота 3) серная кислота
2) угольная кислота 4) фосфорная кислота.
3. Формула азотной кислоты
1) Н2СO3, 2) H2 SO4 3) Н3РO4 4) НNO3
4. Нерастворимая кислота l) Н2СO3, 2)H2SO4 3) Н3РO4
5. Двухосновная кислота 1) HCl 2) Н2СO3, 3) Н3РO4
6. С кислотами не реагирует: 1) Са 2) Сu 3) Zn
Эталон ответа
1. 3 2. 2 3. 4 4. 3 5. 2 6. 2
6 верно - «5»
5 верно – «4»
3-4 верно – «3»
Поставьте сами себе оценку, после того как сверите свои ответы с ответами на эталоне. Отметьте свои оценки на шкале.
V. Домашнее задание:
1. Выучить название кислотных остатков
2. Учебник § 33 , вопросы № 2,3 стр112
Заполнить анкету. Поставьте себе отметку за урок.
| 1.На уроке я работал (а)
2.Своей работой на уроке я
3.Урок для меня показался
4.За урок я
5.Мое настроение
6.Материал урока мне был
7.Домашнее задание мне кажется | активно / пассивно
доволен / не доволен
коротким / длинным
не устал / устал
стало лучше / стало хуже
понятен / не понятен
полезен / бесполезен
интересен / скучен
легким / трудным
интересно / не интересно |