| Этапы урока | Действия учителя | Действия учеников |
| |
| Актуализация опорных знаний у учащихся по ранее изученному материалу.
| Ответить на вопросы: - Какую тему мы изучали на протяжении последних уроков? - Какие соединения химических элементов мы уже изучили? - Какие вещества называют основаниями? - На какие группы можно разделить основания? Учитель предлагает выполнить самостоятельно в рабочих листах задание № 1 (под * на дополнительную оценку) | Ответы учащихся.
Задание № 1 Составьте формулы соединений, образованных атомами: Назовите эти соединения. водорода и хлора; магния и кислорода. *водорода и серы; кальция и хлора. *фосфора и кислорода; азота и водорода. Определите С.О. элементов в следующих веществах: N2, AlCl3, RClO3 *Fe, SiF4, Na2SO3 *O3, SO2, H4P2O7 Запишите формулы оснований: гидроксид натрия, гидроксид калия, гидроксид цинка, гидроксид свинца. |
| 1 шаг. Инициация учащихся. | Познавательная задача. - Мы изучаем классификацию неорганических веществ. Сегодня нам с вами предстоит знакомство с еще одним классом, но с каким именно вы узнаете, правильно выполнив задание № 2.
- Из букв правильных ответов мы с вами и определим название класса веществ, которое будем сегодня изучать.
- Название какого класса веществ мы получим из букв: О, С, Т, Ы, Л, К, И ? | Задание № 2 Определите тип каждой из реакций, уравнения, которых записаны в таблице: | Уравнения реакций | Тип химической реакции | | Соединения | Разложения | Замещения | Обмена | | Mg+H2SO4=MgSO4+H2 | В | Б | О | М | | 2Na+S=Na2S | С | Д | Ж | Н | | 2Fe(OH)3=Fe2O3+3H2O | Г | Т | У | З | | KOH+HCl=KCl+H2O | Л | Е | В | Ы | | 2Сa+O2=2CaO | Л | Н | Г | Б | | Mg+CuCl2=Cu+MgCl2 | З | П | К | Д | | CaCO3=CaO+CO2 | Р | И | Ф | А |
кислоты |
| 2 шаг. Подводящий диалог к теме урока. Формулировка Проблемы. | - Дайте названия соединениям, участвующим в выше предложенных реакциях - Обратите внимание! - Почему некоторым химическим формулам в таблице вы не дали названий? - Совершенно верно. Сегодня мы расширим ваши знания о сложных веществах и познакомимся с еще одним классом неорганических соединений кислотами. - Итак, тема нашего урока: «Кислоты». | Ответы учащихся.
Данные формулы нельзя отнести ни к оксидам, ни к основаниям, потому что они не соответствуют им по составу.
|
| II. Фаза урока РЕАЛИЗАЦИЯ/ОСМЫСЛЕНИЕ. |
| Поиск решения проблемы (открытие нового знания). 1 шаг. Правила техники безопасности.
| - Первое, что вы должны знать при работе с кислотами, это: «Правила техники безопасности». Учитель знакомит учащиеся с «Инструкцией по технике безопасности при работе с кислотами». При работе с кислотами необходимо соблюдать некоторые правила техники безопасности: Необходимо наливать в пробирку количество кислоты, которое указано в инструкции. Заполнять пробирку можно только на 1/3 объема. Взбалтывать вещества следует, слегка покачивая пробиркой, при этом не закрывать ее отверстие пальцем. При разбавлении концентрированной серной кислоты выделяется большое количество теплоты. Поэтому смешивать концентрированную кислоту с водой следует с большой осторожностью:
вливать серную кислоту в воду, а не наоборот. Если вливать воду в
серную кислоту, то часть воды за счет выделения теплоты может нагреться до кипения. Кислота начнет разбрызгиваться и может попасть на кожу, в глаза. Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, а затем раствором Учитель проводит демонстрационный опыт растворения в воде концентрированной H2SO4. Наблюдается сильное разогревание пробирки. Фиксирует внимание учащихся на том, что в связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, оказывается на поверхности, закипает, и ее брызги вместе с кислотой могут обжечь лицо и руки. | Запомни:
Сначала – вода,
Затем – кислота –
Иначе случится беда! |
| 2 шаг. Дегустация. | - Учащиеся должны убедиться в том, что большинство кислот кислые на вкус. В химическом кабинете ничего нельзя пробовать на вкус. Почему? - Но сегодня перед вами лежит таблетка аскорбиновой кислоты, ее (в виде исключения) можно попробовать. Кроме того, вспомните вкус клюквы, щавеля, уксуса. Учащиеся делают вывод. | Ответы учащихся:
Это грубейшее нарушение ПТБ.
Все кислоты кислые на вкус. (Салициловая – сладкая, никотиновая – горькая). |
| 3 шаг. Непосредственный контакт с новой информацией. | Учитель знакомит учащихся с определением кислот, с важнейшими представителями кислот, формулами, названиями. - Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. - Общую формулу кислот можно записать так: НnКоn- , где H- атом водорода, Ко -кислотный остаток, n – индекс (количество атомов водорода), n- – заряд кислотного остатка. | HNO3 – азотная кислота | HCl – хлороводородная кислота | | HNO2 – азотистая кислота | HF – фтороводородная кислота | | H2SO4 – серная кислота | | | H2SO3 – сернистая кислота | | | H2CO3 – угольная кислота | | | H2SiO3 – кремниевая кислота | | | H3PO4 – фосфорная кислота | | 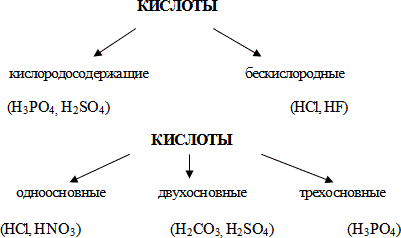 Заранее подготовленные учащиеся дают краткую информацию о кислотах. Учитель предлагает выполнить задание № 3. | Подготовленные ученики рассказывают мини – сообщения по кислотам: Серная кислота Соляная кислота Азотная кислота Борная кислота Ацетилсалициловая кислота Лимонная кислота
Задание № 3 Составить 2-3 тонких и толстых вопроса по теме урока:
|
|
| Изменение окраски индикаторов в кислых средах - Индикаторы («указатели») – вещества, которые под действие кислот и щелочей изменяют свой цвет. Открыты Р. Бойлем. Учитель предлагает выполнить задание № 4. На столах учащихся: индикаторы – лакмус фиолетовый, метиловый оранжевый, фенолфталеин, универсальный индикатор, пробирки под номерами 1, 2, 3. В первой пробирке – кислота, во второй – щелочь, в третьей – вода. Сделать вывод.
|
Задание № 4 Лабораторная работа: Используя таблицу «Изменение окраски индикаторов в зависимости от среды», распознать, в какой пробирке находится кислота. Вывод: «Минеральные и органические кислоты проявляют общие свойства, обусловленные общностью их строения». |
| III. Фаза урока РЕФЛЕКСИЯ/САМОРЕФЛЕКСИЯ. |
| Творческая переработка и интерпретация полученной информации.
| Задание № 5 «Склеенное слово». Перед вами «текст», в котором «спрятаны» формулы кислот. Просмотрите текст и найдите формулы кислот, подчеркните и назовите их, Определите валентность кислотных остатков. H2OSO3H3PO4Na2CO3MgAlPO4H2ОSP2O5CHNO3O2HClBaOSH2CO3Na2O
H2SO4NH3Mg(OH)2Ba(OH)2OSNH2K3NH2SNaClN2O5BaH2Ca(OH)2Al2O3 Выберите формулу «третьего лишнего» вещества в каждом ряду: а) HCl H2SO4 K2O б) HNO3 H2O H2CO3 в) H2S H2SO4 NaOH Составить синквейн 1.КИСЛОТЫ 2._______________________ 3._______________________ 4._______________________ 5._______________________ |
|
| Учитель предлагает учащимся заполнить таблицу. Поставить знаки «+» или « - » в столбцах, в соответствии с ощущениями, полученными в процессе урока:
| П (понравилось) | Н (не понравилось) | И (было интересно, хотелось бы узнать ещё) | |
|
|
|
|
| Домашнее задание. | 1. Прочитать параграф № 26 . 2. Вопрос 4 стр. 90
|

















