Цель урока: определение химических свойств кислот: действие кислот на индикаторы, взаимодействие с металлами и их оксидами, основаниями, солями, разложение некоторых кислот. Повторение понятия об индикаторах, ряде активности металлов, сущности реакции обмена и замещения. Ознакомление с правилами техники безопасности при работе с кислотами.
Оборудование: компьютер, проектор, презентация «Химические свойства кислот», таблица ряда активности металлов, опорный конспект для учащихся.
Лабораторное оборудование:медь, цинк, магний, растворы серной и соляной кислот, оксид меди (II), универсальный лакмусовый индикатор, пробирки, пробиркодержатель, спиртовка.
Тип урока: урок – устный журнал
Методы:использование ИКТ, работа в парах, эксперимент, игровые методики, релаксация.
Девиз урока: «Мне необходимо разобраться самому, а чтобы разобраться самому, надо думать сообща»
Ход урока
I. Организационный момент.
II. Мотивация учебной деятельности.
(Презентация, слайд 1.)
Сегодня на уроке мы с вами продолжим изучать кислоты. Более подробно остановимся на их химических свойствах. Тема урока «Химические свойства кислот»
(Презентация, слайд 2.)
Девиз урока: «Мне необходимо разобраться самому, а чтобы разобраться самому, надо думать сообща»
(Презентация, слайд 3.)
В чем же мы с вами будем сегодня разбираться?
Но сначала я хочу вас спросить: «Любите ли вы читать журналы? Какие вы читаете журналы? Какие рубрики вам нравятся?
(Презентация, слайд 4.)
Сегодня на уроке мы так же будем читать журнал, который называется «Кислоты».
(Презентация, слайд 5.)
1. Первая страница журнала: « Служба знакомств».
Вы с кислотами начали знакомиться на предыдущем уроке.
(Презентация слайд с веществами, где ученики находят кислоты и называют их.)
а) Какие вещества называются кислотами?
б) Как кислоты классифицируют по содержанию кислорода?
в) Как кислоты классифицируют по основности?
г) Как определить валентность кислотного остатка?
На партах розданы карточки с формулами разных кислот, каждый ученик представляет определённую кислоту.
Задание для учащихся: назвать кислоту, проклассифицировать её по содержанию кислорода и по основности, определить валентность кислотного остатка (задание записать в опорный конспект)
Учитель выборочно проверяет правильность выполненных заданий.
(Презентация, слайд 6.)
2. Вторая страница журнала: « Кулинарные рецепты».
Мы должны убедиться, что большинство кислот кислые на вкус. Но одно из правил техники безопасности гласит: «Ничего нельзя пробовать на вкус». Помните, что пробовать на вкус вещества в кабинете химии – это грубое нарушение правил техники безопасности, но сегодня мы сделаем исключение. Немало кислот есть в нашей еде. Фрукты и овощи, молочные продукты, лекарства дают нам целый букет кислот: яблочная, щавелевая, лимонная, молочная, масляная, винная и т.д. Это всё органические кислоты. Разрешаю вам попробовать аскорбиновую кислоту.
(Ученики пробуют аскорбиновую кислоту и записывают вывод в опорный конспект.)
Вывод: большинство кислот кислые на вкус.
(Презентация, слайд 7.)
3. Третья страница журнала: «Осторожно!»
Невыполнение правил поведения с кислотами приводит к сильным ожогам.
Концентрированные кислоты обуславливают обезвоживание кожи, других тканей. Некоторые из концентрированных кислот раздражают слизистые оболочки дыхательных путей. Когда кислота попадает на руки, лицо, кожу следует промыть водой и обработать 5% раствором соды.
(Презентация, слайд 8.)
4. Четвертая страница журнала: «Тест».
Test – с английского, опыт, попытка. Проведем тест на кислоты. Кислоты определяют с помощью индикаторов.
Что такое индикаторы? Индикаторы бывают природные и химические.
(Презентация, слайд 9.)
Природные индикаторы: красная капуста, раствор малины, вишни, красная и черная смородина под действием кислот приобретают красную окраску.
(Презентация, слайд 10.)
Химические индикаторы:(демонстрация таблицы «Изменение окраски индикаторов в разных средах»)
(Презентация, слайд 11.)
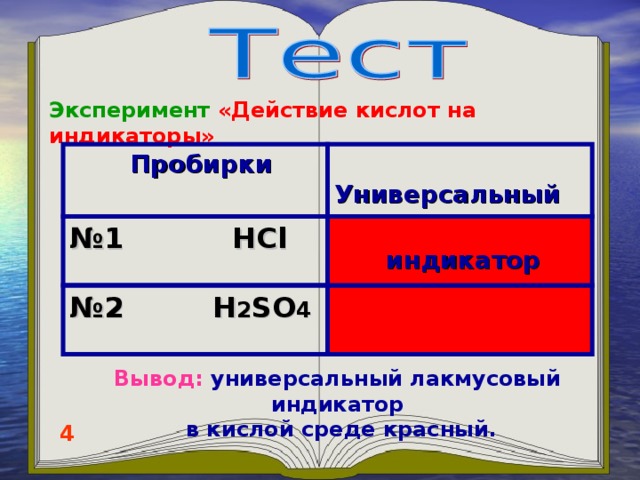
Эксперимент:Действие кислот на индикаторы.
(Работа в парах: на каждую парту розданы кислоты: I-III ряд – HCl;
II ряд– H2SO4
В пробирку наливаем раствор HCl (H2SO4) объемом 1 мл и опускаем полоску универсального индикатора. Наблюдение записываем в таблицу.
№ ряда
Название кислоты
Универсальный индикатор
I -III
Соляная (HCl)
красный
II
Серная (H2SO4)
красный
Вывод: с помощью индикаторов кислоты можно определить среди других веществ.Универсальный индикатор в кислой среде красный.
(Презентация, слайд 12.)
5. Пятая страница журнала: «Политика».
На данной странице журнала мы узнаем с какими веществами реагируют кислоты? Они реагируют:
- с простыми веществами;
- со сложными веществами
- Взаимодействие кислот с простыми веществами.
(Работа в парах: на каждую парту розданы металлы: I ряд – Zn (гранулы);
IIряд – Mg (порошок);
III ряд – Сu (проволока).
Эксперимент: Взаимодействие кислот с металлами.
Учащиеся каждого ряда к указанным металлам добавляют выданные кислоты.
Наблюдение записывают в таблицу.
№ ряда
Ход опыта
Уравнение реакции и ее тип
Признаки реакции
К цинку прилили раствор соляной кислоты
Zn + 2HCl = ZnCl2 + H2
реакция замещения
выделяется газ
II
К магнию прилили раствор серной кислоты
Mg + H2SO4 = MgSO4 + H2
реакция замещения
выделяется газ
III
К меди прилили раствор соляной кислоты
Cu + HCl
реакция не идет
Вытеснительный ряд металлов (работа с учебником «Химия 8 класс», Г.Е. Рудзитис, Ф.Г. Фельдман, М.: Просвещение, 2014 г. с. 154.)
Вывод: с растворами кислот реагируют только металлы, стоящие в ряде активности металлов до Н2.
(Презентация, слайд 13.)
Взаимодействие кислот со сложными веществами.
Демонстрационный эксперимент:
Взаимодействие кислот с основными оксидами: на дно пробирки насыпаем черный порошок CuO, доливаем раствор серной кислоты. Пробирку нагреваем.
Ученики записывают уравнение данной реакции, указывают признаки реакции, тип реакции. Дают определение реакциям обмена.
Условия протекания реакций обмена до конца:
- образование воды;
- образование осадка;
- образование газа
(Презентация, слайд 14.)
- Взаимодействие кислот с основаниями.
(работа с учебником «Химия 8 класс», Г.Е. Рудзитис, Ф.Г. Фельдман, М.: Просвещение, 2014 г. с. 154, таблица 12)
(учащиеся записывают уравнение реакции, указывают тип реакции)
(Презентация, слайд 15.)
- Взаимодействие кислот с солями.
(работа с учебником «Химия 8 класс», Г.Е. Рудзитис, Ф.Г. Фельдман, М.: Просвещение, 2014 г. с. 154, таблица 12)
(учащиеся записывают уравнение реакции, указывают тип реакции)
(Презентация, слайд 16.)
- Разложение слабых кислот
(работа с учебником «Химия 8 класс», Г.Е. Рудзитис, Ф.Г. Фельдман, М.: Просвещение, 2014 г. с. 154, таблица 12)
(учащиеся записывают уравнение реакции, указывают тип реакции)
Таким образом, пролистав страницы нашего журнала «Кислоты», мы с вами выучили их химические свойства.
III. Закрепление выученного.
(Презентация, слайд 17.)
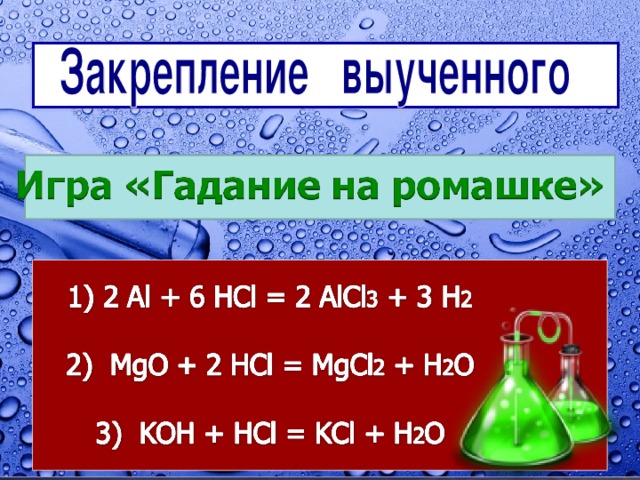
Игра «Гадание на ромашке»
Оторвать лепестки с формулами веществ, которые не реагируют с кислотой в центре цветка. Написать возможные реакции.
Учащиеся записывают уравнения возможных реакций на доске.
(Презентация, слайд 18.)
IV. Подведение итогов (релаксация).
(Презентация, слайд 19.)
Продолжить фразу:
1. Сегодня я узнал …
2. Я получил …
3. Было трудно …
4. Я понял, что …
5. Теперь я могу …
6. Я научился …
7. У меня получилось …
8. Урок дал мне для жизни …
9. Мне захотелось …
(Презентация, слайд 20.)
VI. Домашнее задание.
§45, с. 155 № 3 - 5