| I. Мотивация. На экране слайд № 1. Определите формулу вещества по следующим данным: молярная масса равна 329г/моль, массовые доли химических элементов в этом соединении: калия – 35,56%, железа – 17,02%, углерода – 21,88% и азот. Элементы разместить в порядке возрастания электроотрицательности. (ученики решают задачу в тетрадях) Ответ: K3 Fe C6 N6 Вам знакома формула этого соединения? К какому классу веществ оно может принадлежать? Хорошо растворяется в воде. Но это упрощенная запись. Это вещество может быть выражено другой формулой (на экране слайд № 2) K3[Fe (CN)6] Эта формула и будет нашей учебной задачей. Она выражает новые для вас понятия о состоянии вещества, которое называется в химии «комплексное соединение». Я напомню вам значение слова «комплекс» - это совокупность предметов, составляющих одно целое. Наша цель сегодня – разобраться в комплексных соединениях. На ваш взгляд, что нужно о них знать? Вот мы и вышли на тему нашего урока «К о м п л е к с н ы е с о е д и н е н и я» (на экране слайд № 3) Форма нашего урока «Научно – популярный альманах», перелистывая страницы которого мы ответим на вопросы: Что такое комплексные соединения? Значимость комплексных соединений в реальной жизни. (на экране слайд № 4) Работаем сегодня по парам. У вас на столах лежат конверты с заданиями для самостоятельной работы по вариантам, и весь необходимый для урока комплект наглядных пособий.
II. Изучение нового материала и первичный контроль. Первая страница нашего журнала «Историческая» (на экране слайд № 5) Историческую справку дают ученики…….. Немного добавлю я. Интересный факт: в 1943 году датский физик, лауреат Нобелевской премии Нильс Бор, спасаясь от гитлеровских оккупантов, был вынужден покинуть Копенгаген. Но у него хранились две золотые Нобелевские медали его коллег: немецких физиков – антифашистов Джеймса Франка и Макса Лауэ (медаль самого Бора была вывезена из Дании раньше). Не рискуя взять медали с собой, ученый растворил их в царской водке (Au + HNO3 +4HCl = H[Au Cl4] + NO + 2H2O) и поставил ничем не примечательную бутылку подальше на полку, где пылились много таких же бутылок и пузырьков с различными жидкостями. Вернувшись после войны в свою лабораторию, Бор прежде всего нашел драгоценную бутылку. По его просьбе сотрудники выделили из раствора золото и заново изготовили обе медали. Вторая страница журнала «Информационная» (на экране слайд № 6) Слушая объяснения нового материала, составляете конспект по плану: План конспекта: Что такое комплексные соединения? Особенности строения комплексных соединений. Алгоритм названия комплексных соединений. 1). Соединения, имеющие в своём составе комплексные ионы (анионы или катионы), относятся к комплексным соединениям. 2). Для объяснения строения и свойств комплексных соединений швейцарский химик А.Вернер в 1893году предложил координационную теорию, согласно которой любое комплексное соединение можно рассматривать следующим образом: (на экране слайд № 7) в комплексном соединении один из ионов или атомов считается центральным, его называют комплексообразователем; вокруг центрального иона (атома) – комплексообразователя расположено (координировано) определенное число противоположно заряженных ионов или полярных молекул, называемых лигандами (лиганд, т.е. связанный); центральный ион (атом) с лигандами образует внутреннюю координационную сферу соединения, которую при написании заключают в квадратные скобки; число лигандов, способных присоединиться к центральному иону (атому), определяется координационным числом, которое принимает значения 2,4,6,8. Рассмотрим с точки зрения координационной теории строение соединений: [NH4]Cl и Na2[Cu (OH)4] К каким классам относятся эти вещества? Что может происходить с этими веществами в растворах или расплавах? (диссоциация электролитов) Запишите уравнение диссоциации этих электролитов. [NH4]Cl = [NH4]+ + Cl- Na2[Cu (OH)4]= 2Na+ + [Cu (OH)4]2- Какие вы видите катионы и анионы? Таким образом, катионы и анионы тоже могут быть комплексными.
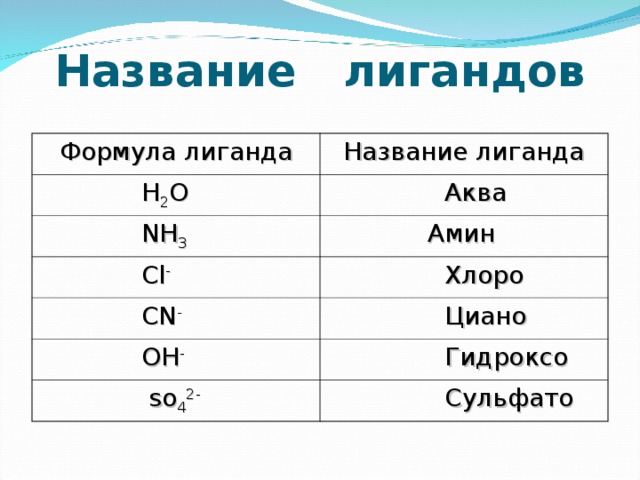
Обратите внимание на экран. Перед вами таблица с названиями и формулами лиганд. (на экране слайд № 8) Такие же таблицы находятся у вас на столах (приложение 2) Алгоритм названия комплексных соединений выглядит так (на экране слайд №9) 1.Первым указывают анион в именительном падеже. 2.Далее катион в родительном падеже, независимо от того, какой из этих ионов комплексный. 3.Название комплексного иона строится так: координационное число (2 – ди,3 – три,4 – тетра…) название лиганда название комплексообразователя число, указывающее валентность (степень окисления) комплексообразователя (записывается римской цифрой в круглых скобках) Пример: K2[PtCl6] – гексахлорплатинат (IV) калия На данном примере рассмотрим, как определяются степени окисления и заряды ионов в комплексных соединениях? III.Закрепление изученного материала. На столах таблицы, в которых вы должны вписать названия комплексных соединений, т.о. проверим, как вы усвоили материал (приложение 3).. А теперь внимание на экран (на экране слайд №10), проверьте себя, пожалуйста. Правильные ответы говорят о том, что мы можем перелистывать следующую страницу. Третья страница «Экспериментальная» (на экране слайд №11) Пользуясь инструкциями, которые лежат у вас на столах, получите комплексное соединение на основе ионов меди. Запишите уравнение реакции получения комплексного соединения (приложение 4). Далее вам предстоит индивидуальная работа. Карточки с заданиями лежат на партах. На работу отводится 3 минуты. Оценку за выполненную работу я выставлю на следующем уроке (приложение 5). Открываем последнюю страницу нашего журнала «Знаете ли Вы, что…» экран (на экране слайд №12), где мы узнаем о значимости комплексных соединений в реальной жизни. Некоторые ученики получили задание – подготовить краткое сообщение, о каком – либо комплексном соединении (приложение 6) Итак, комплексные соединения имеют большое значение в различных областях науки и техники. Их используют: в производстве кислот, СМС и лаков; для получения металлов высокой степени частоты; в аналитической химии для определения ионов металлов; в медицине в качестве стимуляторов важных биохимических процессов (на экране слайд №13). IV. Подведение итогов ( на экране слайд №14). Итак, подведем итог: Что вы узнали нового на уроке? Есть ли у вас вопросы по теме урока? Является ли наш класс сегодня комплексным соединением? Какой же вывод можем сделать из того, что вы увидели? Вывод: комплексные соединения чрезвычайно разнообразны по составу и строению, т.к. может быть много различных комбинаций не только из разных, но и одних и тех же компонентов. V. Рефлексия. Спасибо за урок. Я хочу услышать от вас продолжение следующих фраз об уроке: 4 я познакомился с . было непросто ... я добился у меня получилось .. хотелось бы ... мне запомнилось VI Домашнее задание (на экране слайд №15) 1.Учить конспекты в тетрадях; 2.В соответствии с координационной теорией составить и назвать комплексное соединение по следующим данным: Мир веществ богат и разнообразен. Он открывает свои тайны тому, кто настойчиво добивается этого (на экране слайд №16).
| 
![K 3 [Fe(CN) 6 ]](https://fsd.kopilkaurokov.ru/uploads/user_file_562e4ff8af815/img_user_file_562e4ff8af815_0_1.jpg)





![Алгоритм названия комплексных соединений 1. Первым указывают анион в именительном падеже. 2. Далее катион в родительном падеже, независимо от того, какой из этих ионов комплексный. 3. Название комплексного иона строится так: координационное число (2 – ди, 4 – тетра, 6 – гекса…) название лиганда название комплексообразователя число, указывающее валентность (степень окисления) комплексообразователя (записывается римской цифрой в круглых скобках) Пример: K 2 [PtCl 6 ] – гексахлороплатинат ( IV) калия](https://fsd.kopilkaurokov.ru/uploads/user_file_562e4ff8af815/img_user_file_562e4ff8af815_0_8.jpg)
![Названия некоторых комплексных соединений Формула Название K 2 [PtCl 6 ] Гексахлороплатинат ( IV ) калия [ Cr(H 2 O) 6 ]Cl 3 Хлорид гексааквахрома ( III ) K 2 [Zn(OH) 4 ] Тетрагидроксоцинкат калия [ Cu(NH 3 ) 4 ](OH) 2 Гидроксид тетрааминмеди ( II ) Fe 4 [Fe(CN) 6 ] 3 Гексацианоферрат ( II ) железа ( III )](https://fsd.kopilkaurokov.ru/uploads/user_file_562e4ff8af815/img_user_file_562e4ff8af815_0_9.jpg)





















