Муниципальное образовательное учреждение «Зенинская средняя образовательная школа Вейделевского района Белгородской области»
Тема урока «Кислород, его характеристика, химические свойства, значение»
Цель: обобщение и систематизация знаний по теме « Кислород. Оксиды»
Класс 8.
Урок составила и провела:
учитель биологии и химии
Пушкарёва Татьяна Васильевна
Тема урока «Кислород, его характеристика, химические свойства и значение» Слайд №1
Эпиграф к уроку :
«Кислород- это вещество,
вокруг которого вращается земная химия»
Я.Берцелиус
Цели урока:
Обучающие – обобщить и систематизировать знания учащихся по теме «Кислород»; закрепить знания по характеристике и роли кислорода в природе и жизни человека, решении экологических проблем; провести расчёты экологического мониторинга; отработать практические навыки работы с химическим оборудованием и реактивами; использовать на уроке интерактивную доску.
Развивающие – развивать интеллектуальные и познавательные умения учащихся добывать самостоятельно знания, обобщать и делать выводы, фиксировать главное в свернутом виде.
Воспитательные – содействовать воспитанию организованности учащихся, духа соревновательности при подготовке к уроку и во время урока, решении поставленных задач и проблемных вопросов.
Оборудование к уроку:
Использование ИКТ:
При подготовке используются средства программы Microsoft Word, Microsoft Power Point (Презентация)
Компьютер, мультимедийный проектор. интерактивная доска SMART Board .
Приборы и реактивы: три колбы по 250 мл с кислородом, фосфор, сера, лучина, перманганат калия, прибор для получения газа, пробирка для собирания кислорода путём вытеснения воды, колба для собирания кислорода. демонстрационный столик, ложки для сжигания веществ, , спиртовка, спички.
Ход урока.
Учитель. Ребята , мы сегодня проведём урок обобщения главы «Кислород. Горение » посредством выполнения
проекта «Кислород, его характеристика и значение».
При подготовке проекта вы были разделены на три группы и каждая группа проводила исследования: первая группа теоретические исследования по истории открытия кислорода и состава воздуха, используя дополнительную литературу,
вторая группа проводила экологический мониторинг по исследованию кислорода. третья группа практические исследования по получению и свойствам кислорода ,
Учитель. Сейчас расскажет о своих исследованиях первая группа, проводившая теоретические исследования.
I.Теоретические исследования
Ученик.
История открытия кислорода. Слайд №2-4
Первоначальное открытие кислорода принадлежит китайскому ученому, жившему в 8 веке Мао Хоа, который установил, что в состав воздуха входит газ, поддерживающий горение и дыхание. В 1750 году М.В. Ломоносов на основании своих опытов доказал, что в состав воздуха входит кислород.
В 1774 году английский химик Джозеф Пристли при разложении оксида ртути получил газ(кислород) и назвал его воздухом. Одновременно сделал это открытие и шведский химик Карл Вильгельм Шееле. Но Пристли зарегистрировал своё открытие и поэтому именно он является первооткрывателем кислорода. Великий французский химик Антуан Лавуазье в 1775 г экспериментально доказал, что воздух – это смесь двух газов – азота и кислорода, что кислород входит и в состав других веществ Дал название этим газам:
Жизненный воздух- oxigenium-кислород, Безжизненный- nitrogenium- азот.
Общая характеристика и нахождение в природе кислорода Слайд№5
Ученик записывает на интерактивной доске
Химический знак …
Относительная атомная массаAr … Химическая формула … Относительная молекулярная масса Mr … Валентность равна …
Учитель Где же на Земле встречается кислород? Слайд №6-7
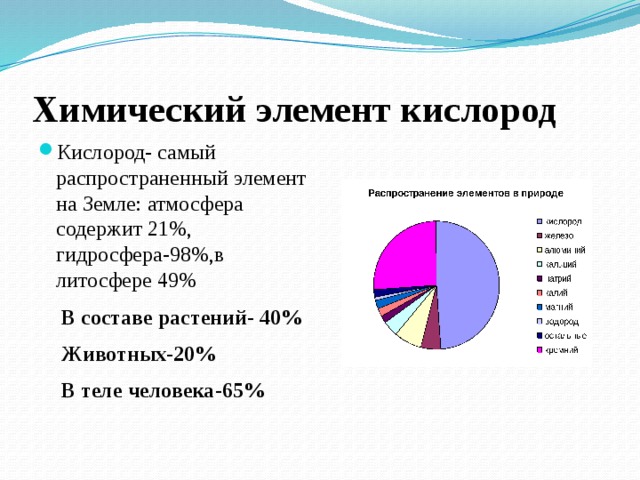
Ученик. Это наиболее распространённый на Земле химический элемент.
В земной коре его 49 %, в гидросфере – 89 %.в атмосфере 21%. В состав растений- 40%, животных-20% , человека 65% Атмосфера земли состоит из 78% азота, 21% кислорода, 0,93% аргона, 0,03% углекислого газа и 0,01% приходится на долю всех остальных газов - водорода, гелия, неона, криптона, ксенона, радона. Атомы кислорода могут присоединяться к другим молекулам кислорода с образованием озона, формула которого О3 . Он образует озоновый слой, максимальная концентрация которого находится на высоте 20-25 км, который защищает нашу планету от губительного ультрафиолетового излучения.
Экология атмосферы Земли.
Учитель. Как меняется состав воздуха? Слайд№8
Ученик. Воздух загрязняется как по естественным причинам (извержение вулканов, пыльные бури…), так и из-за хозяйственной деятельности человека. Его состав при этом меняется. Атмосфера содержит много пыли, которая попадает туда с поверхности Земли и частично из космоса. При сильных волнениях ветры подхватывают капли воды из морей и океанов. Вместе с каплями воды в атмосферу попадают и соли. В результате извержения вулканов, лесных пожаров и других природных явлений воздух загрязняется продуктами сгорания. Результат деятельности человека это автомобили и другие виды транспорта, тепловые электростанции, горящие годами мусорные свалки , выбросы различных химических заводов, и другое. Оксиды углерода , оксиды азота – самые распространенные загрязнители, делающие атмосферу неблагоприятной для жизни человека и животных. Проблема охраны окружающей среды стоит перед человечеством очень остро. Её можно решить только путём международного сотрудничества в области охраны воздуха: правильное сжигание топлива, строительство очистных сооружений, совершенствование технологий в промышленности, модернизация транспорта, расширение площадей зелёных насаждений.
Учитель. Ребята , вы прослушали сообщения которые подготовила первая группа.
Так кто же является первооткрывателем кислорода? (Дж. Пристли) А кто определил состав воэдуха и дал название кислороду? (А.Лавуазье)
Ученик . Впервые получил кислород Джорж Пристли, а дал ему название Антуан Лавуазье. Учитель Сколько % составляет кислород в воздухе? Ученик. Кислород составляет 21% Учитель .Каковы причины загрязнения воздуха? Ученик. Природные факторы и хозяйственная деятельность человека.. Учитель. Что вы можете сделать для сохранения чистоты воздуха? Ученик. Не жечь мусор, не разводить костры в лесу, сажать деревья… Учитель. Покажет результаты экологического мониторинга вторая группа.
II. Экологический мониторинг. Слайд №9-10
1.Экологические расчёты по примерному расходованию кислорода автотранспортом по улице Школьная в течение 1 часа
Ученик.
За 15 мин.отмечено 19 автомобилей. За 1 час соответственно 19 х 4 = 76 автомобилей. Длина улицы 900 м . Общий путь всех автомобилей находим по формуле
S= 76 х 900 м = 68 4 00 м = 68.4 км
Известно, что на 100 км автомобиль расходует 262, 8 м.куб. кислорода (человек за год при дыхании использует такое количество). Составляем пропорцию и расчитываем количество кислорода ,которое расходуется на 68, 4 км
100 км - 262, 8 м.куб.
68,4 км - Х м.куб. Х= 179. 8 м.куб.
Мы решили вычислить, на сколько часов хватило бы сожжённого автомобилями кислорода ( 179. 8 м.куб) нашему классу для дыхания:
1 мин.1 чел. – 0,5 дм куб
1 час - 30 дм куб
За 1 час 21 чел -630дм куб
179800дм куб : 630 дм = 285часов
285 часов : 24 часа = 12 суток
Учитель. Спасибо , ребята, за интересную информацию и проделанную кропотливую работу по исследованию кислорода. А сейчас ребята из третьей группы проведут химический эксперимент и покажут как можно получить кислород в лаборатории и какими свойствами он обладает.
III. Практические исследования.
Получение кислорода Слайд №11
Ученик.
В природе кислород образуется в процессе фотосинтеза. 6СО2 +6 Н2О = С6 Н12О6 + 6О2 В промышленности его получают перегонкой сжиженного воздуха при температуре – 183 С.
В лаборатории кислород получают реакциями разложения:
Ученик. (реакции записываются на интерактивной доске)
Опыт №1
.Разложение перманганата калия при нагревании.
2КМnО4=К2 МnО4+МnО2 + О2
Опыт №2 Разложение пероксида водорода под действием оксида марганца(IV) (пишет на доске формулу, а затем проводит эксперимент)
2 Н2О2 = 2 Н2О + О2
Реакция разложения воды:
2 Н2О = О2 + 2 Н2
Учащийся собирает кислород методом вытеснения воды и воздуха.
Учитель. Как проверить, наполнился стакан кислородом?
Ученик. Опускают в сосуд тлеющую лучинку, если кислород присутствует – лучинка ярко вспыхивает.
Изучение свойств кислорода.
А) Физические свойства кислорода Слайд №12 Ученик Кислород – это газ без цвета, запаха, вкуса, плохо растворим а воде, тяжелее воздуха, при температуре -183о С превращается в подвижную жидкость. Жидкий кислород – голубого цвета, кристаллический – синего.
Б)Химические свойства кислорода Слайд №13 (Ученики пишут реакции на доске уравнения реакций и демонстрируют опыты.)
Опыт №3 Горение углерода
С+О2=СО2
Опыт №4 Горение серы
S+O2=SO2,
Опыт №5 Горение фосфора
4Р+5О2=2P2O5,
Выводы.
Учитель . Как горели эти вещества в воздухе? (неярко) А как в кислороде? (ярким пламенем) Какое свойство кислорода вы наблюдали?
Ученик. Кислород поддерживает горение.
Учитель. По каким признакам вы можете сказать, что протекает химическая реакция?
Ученик. Выделение тепла и света. Учитель .Как называется такая реакция? Ученик. Называется реакция горения. Учитель. Что общего между этими реакциями? Ученик. В результате реакции образуются оксиды. Учитель. Что такое оксиды? Ученик. Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород.
Учитель. Молодцы ребята , вы внимательно смотрели и сделали правильные выводы.
Учитель. А сейчас, ребята, вы проведёте исследования по группам. Каждая группа получает задание и выполняет его вместе.
Задания по группам
Ученики получают задания на листочках. На каждую группу своё задание. Решают самостоятельно, сверяются, исправляют ошибки и один ученик от группы решает на интерактивной доске.
1 группа Для вещества SO3 , Слайд №14
Дайте название вещества.
Определите валентность каждого элемента в веществе.
Вычислите относительную молекулярную массу вещества.
Вычислите массовую долю кислорода в веществе.
2 группа Для веществ СН4 , К , Слайд№15
1 Запишите реакцию горения . 2. Расставьте коэффициенты. 3. Дайте название полученным веществам. 4. Определите количество кислорода в уравнении.
3 группа. Слайд №16
H2S04, ZuO, HCI, NaOH, H2, CaO, S02, K2C03, N02, Cu, NaN03, H3PO4, Fe203, ZnS, H20, H2S.
Подчеркните в данном списке формулы оксидов.
Определите валентность элементов в формулах оксидов.
Дайте названия оксидам.
Назовите оксиды, где Элемент проявляет валентность I, II, III, IV.
Задание «Найди пару» (выполняется на интерактивной доске) Слайд 17
Учитель. А сейчас задание дано для всех учащихся. Нужно для формулы оксида найти пару название его.
Соедини линиями формулу оксида с соответствующим ему названием.
| Формула оксида | Название оксида |
| P2O5 | Оксид кальция |
| SO2 | Оксид бария |
| CO2 | Оксид железа III |
| NO | Оксид цинка |
| K2O | Оксид фосфора V |
| Fe2O3 | Оксид серы IV |
| ZnO | Оксид углерода IV |
| CaO | Оксид азота II |
| BaO | Оксид калия |
III. Значение кислорода в природе и жизни человека Слайд №18
Ученик.Кислород используют для дыхания все живые организмы В сутки через лёгкие человека проходит 800 л кислорода.
Кислород применяют: в металлургии и химической промышленности, для сварки и резки металлов, для жизнеобеспечения на подводных и космических кораблях, при работе водолазов( в глубоководных скафандрах и некоторых других случаях для дыхания человека применяется смесь кислорода с гелием), пожарных, в медицине – кислородные подушки. Лётчики при высотных полётах пользуются кислородными масками. Если без пищи и воды люди могут прожить несколько суток, то без кислорода – несколько минут.Жидкий кислород применяется в ракетных двигателях. Современный пассажирский самолет при полете в течении 9 часов расходует до 75 тонн кислорода.
Учитель. Какое значение имеет кислород?
Ученик . Без него нет жизни.
Заключительное слово учителя.
Подводя итог урока, хочу спросить
Кто из ученых открыл кислород? Кто дал ему название и определил состав воздуха?
Какой % в воздухе составляет кислород?
Какие факторы влияют на состав воздуха?
По результатам экологических исследований какое количество кислорода расходуется автомобилем? Что мы можем сделать, чтобы количество кислорода не изменялось?
Каким свойством обладает кислород?
Какое значение имеет кислород?
Ребята . вы все приложили много усилий для того . чтобы получился проект, который вы сегодня защищали. Я довольна вашей работой на уроке. А сейчас с помощью небольшого теста вы мне ответите какой , по вашему мнению, получился урок.
Рефлексия. Слайд №19
Тест выведен на доску и дети если согласны, то поднимают табличку «ДА», если не согласны , то поднимают табличку «НЕТ»
Рефлексивный тест
1. Узнал много нового.
2. Мне это пригодится в жизни.
3. На поставленные вопросы я получил ответы.
4. На уроке работал с интересом,
Учитель объявляет оценки за урок.
Домашнее задание: Задача №1 стр. 60, упр. 7 стр. 69 Слайд №20