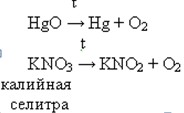Технологическая карта урока по химии
«Кислород, общая характеристика, получение и свойства»
Учитель: Одарченко Т.А. МБОУ «СОШ №31» г. Симферополь
УМК: Г.Е.Рудзитис, Ф.Г. Фельдман.
Урок соответствует разделу программы « Кислород.Горение»,1 урок при изучении данного раздела.
Тема урока - «Кислород, общая характеристика, получение и свойства»
Тип урока – изучение нового материала.
Цели урока:
Предметные: уметь различать понятия «химический элемент» и «простое вещество» на примере кислорода; знать методы получения кислорода в лаборатории и промышленности, методы собирания кислорода, физические свойства кислорода; формированиеумений: составлять характеристику кислорода по плану,
составлять уравнения реакций получения кислорода, объяснять методы собирания кислорода.
Метапредметные: развитие способности к наблюдениям, систематизации информации, способности выделять главное существенное
Личностные: развитие умения управлять своей познавательной деятельностью, готовности к решению задач на выявление сущности того или иного явления природы.
Основные виды деятельности учащихся. Исследовать свойства кислорода.Описывать и характеризовать кислород как химический элемент и как простое вещество, составлять уравнения реакций получения кислорода, определять методы собирания кислорода, описывать физические свойства кислорода.Распознавать кислород опытным путем. Участвовать в совместном обсуждении результатов опытов. Делать выводы из результатов проведенных опытов.
Основные понятия: химический элемент, простое вещество,катализатор.
Демонстрации:получение кислорода при разложении перманганата калия и пероксида водорода;собирание кислорода вытеснением воды и воздуха; доказательство наличия кислорода тлеющей лучинкой; обратить внимание на технику безопасности.
Оборудование урока: комплекс “Компьютер + телевизор” для демонстрации компьютерной презентации к уроку, таблица «Распространенность химических элементов в природе», диаграмма «Распространение элемента кислорода в природе», раздаточный материал для работы в парах.
Применяемые технологии:
технологияразноуровневой дифференциации,
технологии системно-деятельного подхода,
технология проблемного обучения,
технология игрового обучения,
интерактивные технологии.
«Единственный путь, ведущий к знаниям, - это деятельность»
Б.ШОУ.
№ п/п
Этапы урока
Ход урока
Деятельность учителя
Деятельность ученика
I
Мотивация к учебной деятельности
(2 мин)
Цель: проверка готовности учащихся, их настроя на работу
Прозвенел звонок для нас.
Все зашли спокойно в класс.
Встали все у парт красиво,
Поздоровались учтиво. Тихо сели, спинки прямо.
Вижу, класс наш хоть куда.
Начинать урок пора.
Приветствуют учителя, проверяют свои рабочие места.
II
Анализ ошибок контрольной работы «На ошибках- учимся!»
Задание1. Определить валентности элементов по формуле вещества:
а) AlCl3; б) MgS; в) SO3; г) N2O5
Задание2. Составить формулы сложных веществ, состоящих из водорода и следующих химических элементов:
а) азота (III); в) кремния (IV);б) хлора (I);
г) серы (II)
Задание3. Расставить коэффициенты в уравнениях. Подчеркнуть формулы сложных веществ. Определить типы химических реакций:
а) CuO + C = Cu + CO2
б) Fe + H2O = Fe3O4 + H2
в) Al + O2 = Al2O3
г) KNO3 = KNO2 + O2
Выполнение заданий определенной сложности по пройденному материалу.
3
Актуализация знаний и постановка учебной проблемы
(5 мин)
Цель: подведение детей к формулированию темы и постановке задач на уроке.
Это знают все на свете:
Кислород нужен планете.
Это знают даже дети:
Без него не жить на свете.
И животные, и люди –
Все вдыхают кислород.
Без него и у растений
Фотосинтез не идет.
И в больнице дядя доктор,
Чтоб микробы одолеть,
Кислород дает больному,
Чтоб болезнь преодолеть.
А электрогазосварщик,
Чтобы трубы заварить,
Кислород дает в горелку,
Чтобы дырку победить.
Тайны есть у кислорода,
Чтобы их узнать, дружок,
Ты бери скорей учебник,
И в припрыжку на урок!
О каком газе идет речь в данной загадке?
- Какой будет тема урока?
а). Озвучивание темы урока и постановка цели урока.
- На сегодняшнем уроке мы должны выяснить:
1).Какие сведения о кислороде вам уже известны?
2).Почему о кислороде говорят так: «Кислород самый распространенный на нашей планете элемент. Он рождает теплоту человеческого дыхания и обжигающее пламя пожара?»
3). Что общего у песка, рубина, негашеной извести?
- А на какие вопросы вы бы хотели получить ответы в ходе урока
Проблемный вопрос.
– Как вы думаете, почему кислород изучают первым среди других химических элементов?
-Что вам уже известно о кислороде?
Работа в парах.
Отвечают на вопрос.
Формулируют тему урока.
Записывают тему урока в тетради «Кислород, общая характеристика, получение и свойства».Слушают учителя,отвечают на вопросы.
Сообщение 1. «О значении кислорода для живых организмов и в природе».
Сообщение 2. «История открытия кислорода»
4
Совместное открытие новых знаний (20 мин)
Цель: выявление обучающимися новых знаний, развитие умения находить ответы на проблемные вопросы
Задачи: составить представления учащихся о кислороде как химическом элементе и простом веществе.
Первичная проверка усвоения новых знаний
Открытие новых знаний
Введение в тему.
I.Характеристика кислорода как химического элемента по положению в периодической системе химических элементов Д.И. Менделеева и как вещества.
- . Отметьте, в каких случаях речь идёт о химическом элементе кислороде, а в каких – о простом веществе кислороде. Обведите цифру правильного ответа: красным – элемент, синим – вещество.
- Кислород – газ, плохо растворимый в воде.
- Химическая формула кислорода – О2
- В воздухе содержится приблизительно 21% кислорода.
- Относительная молекулярная масса кислорода - 32
- В земной коре содержится приблизительно 47% кислорода.
- Валентность кислорода равна двум.
- Рыбы дышат кислородом, растворённым в воде.
- В промышленности кислород получают из воздуха.
- Химический знак кислорода – О.
- На долю кислорода приходится 89% массы Мирового океана
- Атомная масса кислорода – 16
Обсуждают результаты, подводят итоги, выясняют возникшие вопросы.
III.Физические свойства кислорода.
Ответить на вопрос, полетит ли шарик, надутый кислородом.
Прочитать соответствующий текст в §23.
IV.Получение кислорода.
А).Как образуется кислород в природе?
Б).Как получают кислород в промышленности? Какое сырье используется? При каких условиях протекает реакция разложения воды?
Сжижение воздуха-какое явление?
В). Получение в лаборатории.
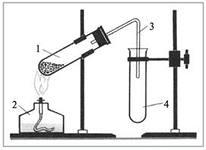
Демонстрационный опыт.Получение кислорода при разложении перманганата калия и пероксида водорода; собирание кислорода вытеснением воды и воздуха; доказательство наличия кислорода тлеющей лучинкой.
На каких свойствах кислорода основаны способы его собирания?
Опыт. Как доказать наличие кислорода?
Учащиеся знакомятся с планом.
План характеристики химического элемента
1.химический знак
2.относительная атомная масса
3.валентность
4.распространение в природе
Работа в группах.
Выполняют задание, обсуждают, выбирают ответы, обводят правильные ответы. Представляют результаты
Сравнивают свою схему со схемами партнёров в группе, сравнивают с образцом.
Выполняют индивидуальную работу
а) Составьте рассказ, используя опорные слова:
атмосфера, земная кора, гидросфера, кислород, распространенность
б) Закончите предложение:
а) Земная атмосфера содержит кислорода…
б) Еще больше в земной коре содержится…
в) В гидросфере его содержание…
г) Кислород – самый…
Учащиеся читают текст, анализируют его, обсуждают вопрос в группе,
Используя ранее полученные знания из природоведения,окружающего мира и биологии, ученики рассказывают о процессе фотосинтеза.
Учащиеся находят ответ в §22,обсуждают промышленные способы получения кислорода.
Проводят наблюдения, записывают уравнения химических реакций, отмечают
условия реакцииполучения кислорода, выясняют роль катализатора.
Ответы учащихся. Предлагают методы доказательства.
5
Закрепление изученного материала
(10 мин)
Цель: освоение способа действия с полученными знаниями в практической деятельности
1.Вычеркните неверные суждения о кислороде.
1. В промышленности получают из воздуха.
2. Сложное вещество.
3. При обычных условиях бесцветный газ.
4. Собирают вытеснением воздуха
5. В природе встречается только в составе сложных веществ.
6. Собирают в перевернутый вверх дном сосуд.
7. В лаборатории получают из перекиси водорода.
8. Газ, имеющий запах.
9. Поддерживает горение.
10. Тяжелее воздуха.
11. Входит в состав минералов, горных пород, песка, воды.
12. При обычных условиях жидкость.
13. Входит в состав воздуха.
14. Образуется в природе в процессе фотосинтеза.
2.Расставить коэффициенты в уравнении,определить тип химической реакции.
На каком свойстве кислорода основано его собирание?
Теперь вернемся к ключевому вопросу урока:
Так что же за вещество кислород: источник жизни или разрушитель?
Учащиеся выполняют задание, выполняют самоконтроль.
Учащиеся отвечают
6
Домашнее задание
Предлагает домашнее задание : §22,упр.1,4-6 ;тестовые задания; §23(физические свойства кислорода). По желанию:
- найти или придумать загадки, поговорки о кислороде;
- написать сказку о кислороде;
- составить кроссворд;
Записывают задание
7
Рефлексия
Создаёт условия для заключительной рефлексии
Стихотворение
Что? Почему? Зачем? И где?
Живут в земле, в огне, в воде.
Вот в первый раз огонь добыт.
(А почему огонь горит?)
Зерно под солнцем проросло.
(Зачем растению тепло?)
Дым лёгкий, а скала тверда.
Что значит лед, а что - вода?
Что? Почему? Зачем? И где?
Мы всё узнать хотим,
Соль растворяется в воде,
А мел нерастворим.
Бумага не сгорит дотла:
В печи останется зола.
А если медь в печи нагреть,
То станет тяжелее медь.
С окалиною вместе.
Не верите – так взвесьте.
Открытий путь - нелёгкий путь,
Но человеку – не свернуть,
Что? Почему? За ним следят,
Чтоб шел вперёд, а не назад.
Вот почему из года в год
Наука движется вперёд!
Оценивают свои знания, планируют задачи на следующий урок.