План:
1. Необратимые и обратимые химические реакции
2. Химическое равновесие
3. Смещение химического равновесия.
1. Необратимые и обратимые химические реакции
При изучении реакций обмена были перечислены условия, при которых они протекают до конца. Эти реакции идут до конца, т.е. она необратимая.
Реакции обмена идут до конца, если
• Выпадает осадок
• Выделяется газ
• Образуется малорастворимое вещество- вода
Известные и такие реакции, которые при данных условиях до конца не идут
Это реакция не идет до конца потому, что одновременно происходят две реакции обратимая и необратимая.
2. Химическое равновесие.
Скорость химических реакции зависит от концентрации реагирующих веществ, то скорость прямой реакции в начале должна быть максимальной, а скорость обратной реакции должна равняться нулю. Концентрация реагирующих веществ с течением времени уменьшается, а концентрация продуктов реакции увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. В определенный момент времени скорости прямой и обратной реакции становятся равными.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
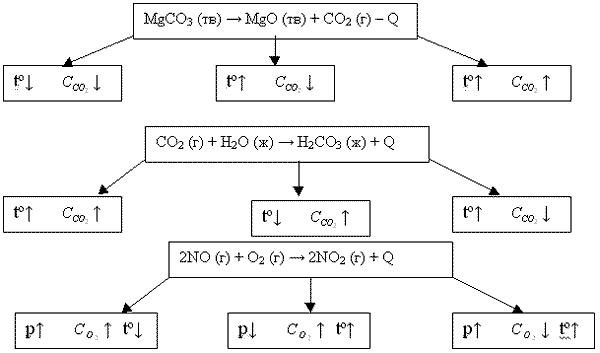
3. Смещение химического равновесия.
Если при изменении какого-либо внешнего условия в состоянии химического равновесия выход желаемого продукта увеличивается то говорят, что равновесие сместилось вправо, если уменьшается- то влево.
Многочисленные исследования показали, что смещение химического равновесия подчиняется правилу, названному принципом Ле-Шателье.
При изменении внешних условии химического равновесия смещается в сторону той реакции, которая ослабляет это внешнее воздействие.
При повышении температур равновесие смещается в сторону эндотермической реакции
При повышении давления равновесия смещается в сторону реакции, ведущей к уменьшению объема.
При увеличении концентрации какого-либо компонента равновесия смещается в сторону его уменьшения.
ВЫВОДЫ:
При повышении концентрации реагирующих веществ равновесие смещается в сторону образования продуктов;
При повышении концентрации продуктов реакции - в сторону образования исходных веществ;
При повышении давления - в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
При повышении температуры - в сторону эндотермической реакции;
При понижении температуры - в сторону экзотермической реакции.