Тема урока: "Фосфор"
Цели:
обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе;
аллотропных видоизменениях фосфора;
повторить зависимость свойств вещества от его состава и строения;
развивать умение сравнивать;
способствовать формированию материалистического мировоззрения, нравственному воспитанию школьников.
Средства обучения:
Мультимедийный проектор, компьютер, презентация Power Point «Фосфор»
Раздаточный материал: таблица “Физические свойства белого и красного фосфора”.
Виртуальная лаборатория диск
Ход урока
I. Мотивация учащихся
Учитель зачитывает отрывок из романа А.Конан-Дойла “Собака Баскервилей”.
слайда №3
“...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана... Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я”.
Из какого произведения этот отрывок? Вот в какой неприятной истории оказался замешан элемент №15. Но могло ли быть такое в действительности, имеет ли фосфор такие свойства, прав ли был А.Конан-Дойл? Выясним сегодня на уроке
II. Изучение нового материала
1. История открытия фосфора
Рассказ учителя:
Фосфор открывали несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что первооткрывателем фосфора был арабский алхимик Альхильд Бехиль (XII век), перегонявший мочу с глиной, известью и углем. Но все же годом открытия фосфора считается 1669-й.
слайда №4
Сообщение история открытия фосфора
Из всех древних и средневековых элементов только фосфору может быть приписана совершенно точная (с точностью до года) дата открытия – 1669 год. Открытие фосфора – это важное и неожиданное событие XVII века.
В поисках эликсира молодости и попытках получения золота разорившийся торговец Хенинг Брандт из Гамбурга пытался изготовить "философский камень" из мочи. Он собрал около тонны мочи из солдатских казарм. Брандт выпарил мочу до сиропообразной консистенции, затем перегнал и получил жидкость красного цвета, которую он назвал уринным маслом. Перегнав эту жидкость еще раз, он обнаружил на дне реторты черный осадок. После долгого прокаливания остаток переходил в белое светящееся вещество, оседавшее на стенках колбы – приемника. Брандт посчитал, что выделил элементарный огонь.
Интерес к новому веществу был огромный. Брандт показывал новое вещество за деньги. Потом за 200 талеров секрет был продан И. Крафту, который также показывал фосфор за деньги (от греческого "фосфор" – "светоносец").
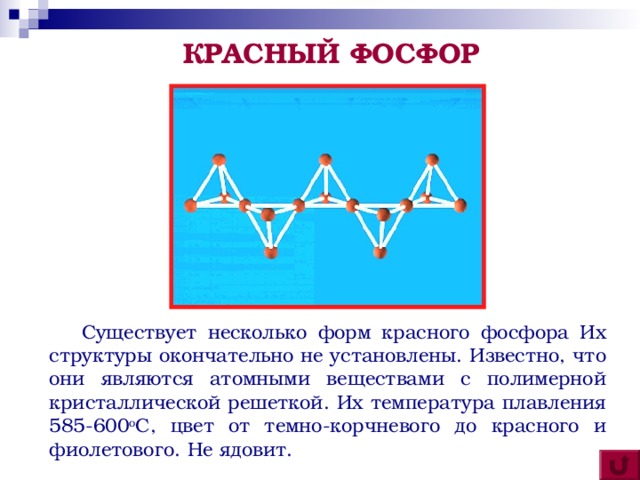
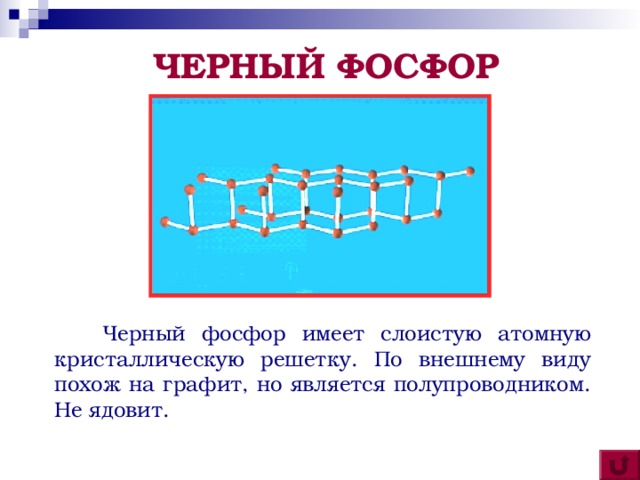
Затем немецкий химик И. Кункель узнал через Крафта рецепт изготовления и сумел получить фосфор, заявив претензию на самостоятельность открытия. В 1680 году фосфор был получен и Бойлем. В 1847 году А. Шреттер получил красный фосфор, нагревая белый фосфор без доступа воздуха до 300 °C, который в отличие от белого, не был ядовит и не воспламенялся на воздухе. В 1934 году Л. Бриджмен, подвергнув фосфор нагреванию при значительном давлении, получил третью модификацию – черный фосфор.
2. Фосфор как химический элемент.
слайд №5
Беседа:
- Каково положение фосфора в периодической системе химических элементов Д.И.Менделеева?
- Составьте схему строения атома фосфора, сделайте вывод о проявлении свойств.
- Определите возможные степени окисления фосфора в соединениях.
- Составьте формулу летучего водородного соединения и высшего оксида, расставьте степени окисления. Каков характер оксида?
3. Аллотропные видоизменения фосфора.
- Необычное светящееся вещество, полученное Брандом, - белый фосфор. Кроме белого, есть еще красный фосфор и черный фосфор. Как называется явление существования нескольких простых веществ, образованных одним химическим элементом?
слайд №6
Сравните физические свойства аллотропных видоизменений фосфора. (Самостоятельная работа учащихся с таблицей)
Таблица “Физические свойства белого и красного фосфора”
| Характеристика вещества | Физические свойства фосфора |
| белого | красного |
| Физическое состояние | Кристаллическое вещество | Порошкообразное вещество |
| Твердость | Небольшая - можно резать ножом (под водой) | - |
| Цвет | Бесцветный с желтоватым оттенком | Темно-красный |
| Запах | Чесночный | Без запаха |
| Плотность (в г/см3) | 1,8 | 2,3 |
| Растворимость в воде | Не растворяется | Не растворяется |
| Растворимость в сероуглероде | Хорошо растворяется | Не растворяется |
| Температура плавления | 44°С | При сильном нагревании превращается в пары белого фосфора |
| Температура воспламенения | 40°С. В измельченном состоянии воспламеняется при обычной температуре. | Около 260°С |
| Свечение | В темноте светится | Не светится |
| Действие на организм | Сильный яд | Не ядовит |
| Характеристика вещества | Физические свойства фосфора |
| белого | красного |
| Физическое состояние | Кристаллическое вещество | Порошкообразное вещество |
| Твердость | Небольшая - можно резать ножом (под водой) | - |
| Цвет | Бесцветный с желтоватым оттенком | Темно-красный |
| Запах | Чесночный | Без запаха |
| Плотность (в г/см3) | 1,8 | 2,3 |
| Растворимость в воде | Не растворяется | Не растворяется |
| Растворимость в сероуглероде | Хорошо растворяется | Не растворяется |
| Температура плавления | 44°С | При сильном нагревании превращается в пары белого фосфора |
| Температура воспламенения | 40°С. В измельченном состоянии воспламеняется при обычной температуре. | Около 260°С |
| Свечение | В темноте светится | Не светится |
| Действие на организм | Сильный яд | Не ядовит |
- Сходны или различны свойства белого и красного фосфора?
- Чем объясняются различия в свойствах?
слайд №6 гиперссылка
Белый фосфор – вещество с молекулярной кристаллической решеткой, состоящей из 4-х атомов в молекуле: P4. Нерастворим в воде, хорошо растворяется в органических растворителях. На воздухе легко окисляется, а в порошкообразном состоянии воспламеняется. Очень ядовит. Светится в темноте. Хранят его под водой.
Красный фосфор – темно-малиновый порошок. Не растворяется ни в воде, ни в органических растворителях. На воздухе окисляется медленно и не самовоспламеняется. Неядовит и не светится в темноте.
Черный фосфор – имеет слоистую атомную кристаллическую решетку
- Как вы думаете, можно ли из одного аллотропного видоизменения фосфора получить другое?
Виртуальна лаборатория Демонстрационный опыт. Получение белого фосфора из красного.
Какова температура воспламенения белого фосфора? Прав ли был А.Конан-Дойл в описании собаки Баскервилей?
Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления катализируется органическими веществами, в частности, шерстью. Поэтому собака Баскервилей не могла быть раскрашена белым фосфором.
4. Химические свойства фосфора
- Фосфор часто называют многоликим элементом. Не только из-за аллотропных видоизменений, но и благодаря химическим свойствам. Этот элемент может проявлять как окислительные, так и восстановительные свойства.
Виртуальная лаборатория «Горение фосфора»
- Составьте уравнение реакции горения фосфора, объясните окислительно-восстановительный процесс.
4Р + 5О2 = 2Р2О5
- слайд №7
С какими веществами фосфор проявляет себя как окислитель?
Составьте уравнение реакции взаимодействия с магнием, назовите продукт.
3Mg + 2P = Mg3P2
слайд №8
В смеси с бертолетовой солью от удара взрывается, воспламеняется.
5KClO3 + 6P = 3P2O5 + 5KCl
Такая реакция происходит, когда мы зажигаем спички. В головке спичек содержится бертолетова соль, в намазке шкурки – красный фосфор.
В 1867 г. от ожогов скончалась итальянская эрцгерцогиня Матильда, которая случайно наступила на спичку, – ее платье было мгновенно охвачено пламенем. В те времена спички были весьма опасны: мало того, что зажигались они очень легко, а порой и неожиданно, в них содержался сильно ядовитый белый фосфор.
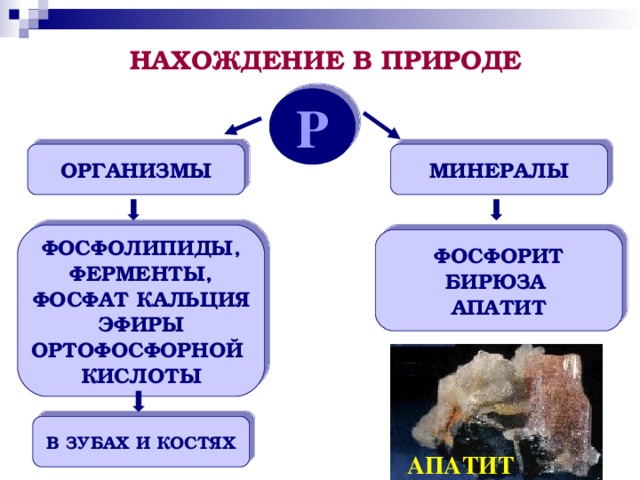
5. Нахождение в природе, получение фосфора
слайд №9
В теле человека массой 70 кг содержится около 780 г фосфора. В виде фосфатов кальция фосфор присутствует в костях. Входит он также в состав белков, фофолипидов, нуклеиновых кислот. Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом. Наиболее богаты фосфором рыба, фасоль, некоторые виды сыра. Для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальция: оптимальное соотношение этих элементов в пище составляет 1,5 : 1. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Стихотворение «Фосфор»
В руках алхимиков впервые
В подвале мрачном засиял.
И чудесами всех факиров
Он многие века снабжал.
Тот светоносец знаменитый
Приходит через века опять,
Не для того чтобы светится.
Чтоб урожаи поднимать.
Он стал фосфористою бронзой,
Дает отличное литье,
Питает фосфор клетки мозга
И входит в спичек коробок.
Он назван элементом жизни,
Но в этом парадокс, друзья:
Есть фосфор в каждом организме.
Но белый фосфор – сильный яд.
-
Каково физиологическое действие белого фосфора?
слайд №10
Доза фосфора в 0,05–0,15 г для человека смертельна. Профессиональным заболеванием рабочих первых спичечных фабрик был фосфорный некроз – поражение челюстей.
Белый фосфор не только является сильным ядом, при попадании на кожу вызывает долго не заживающие ожоги.
слайд №11
В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
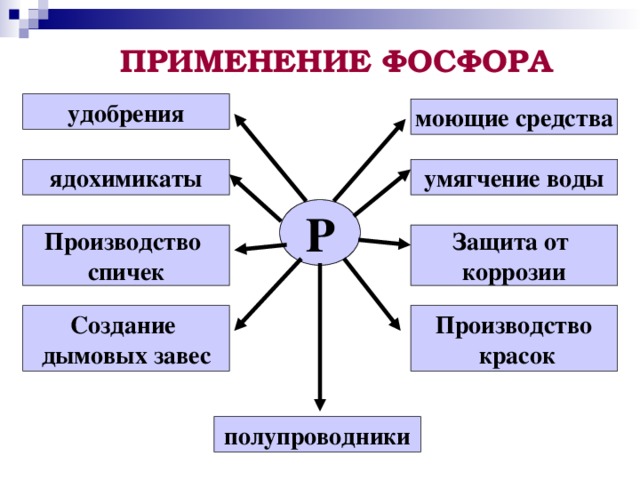
6. Применение фосфора
слайд №12
Главные его потребители – производство спичек, металлургия, химические производства. Фосфор используют в производстве фосфорной кислоты и фосфорных удобрений, полупроводниковых материалов, как компонент покрытий стальных изделий и т. д. Белый фосфор применяют для изготовления трассирующих боеприпасов, как дымообразующее и зажигательное средство, красный фосфор – основной компонент обмазки зажигательной поверхности спичечных коробков.
В недавнем прошлом на военных предприятиях его использовали для приготовления дымовых и зажигательных составов.
Войска США использовали зажигательные фосфорные бомбы во время военной операции вблизи иракского города Эль-Фаллуджа в 2004 году.
слайд №12 гиперссылка
По словам представителя Пентагона, белый фосфор использовали как огневое средство против боевиков и для освещения поля боя. В то же время один из итальянских телеканалов сообщал, что среди жертв фосфорных бомб были женщины и дети.
III. Закрепление изученного
- Как доказать, что белый и красный фосфор – аллотропные видоизменения одного и того же эемента?
- Составьте уравнения реакций взаимодействия фосфора с: а) фтором; б) алюминием. Назовите вещества. Какую роль играет фосфор: окислителя или восстановителя?
С фосфором и его соединениями связано немало легенд и суеверий.
Сообщения учащихся:
1. “Светящийся монах”
Из воспоминаний академика С.И. Вольфковича: “Фосфор получался в электрической печи, установленной в Московском университете на Моховой улице. Так как эти опыты проводились тогда в нашей стране впервые, я не предпринял тех предосторожностей, которые необходимы при работе с газообразным фосфором – ядовитым, самовоспламеняющимся и светящимся голубоватым цветом элементом. В течение многих часов работы у электропечи часть выделяющегося газообразного фосфора настолько пропитала мою одежду и даже ботинки, что когда ночью я шел из университета по темным, не освещенным тогда улицам Москвы, моя одежда излучала голубоватое сияние, а из-под ботинок (при трении их о тротуар) высекались искры. За мной каждый раз собиралась толпа, среди которой, несмотря на мои объяснения, немало было лиц, видевших во мне “новоявленного” представителя потустороннего мира. Вскоре среди жителей района Моховой и по всей Москве из уст в уста стали передаваться фантастические рассказы о “светящемся монахе”...
Подведение итогов урока, комментирование и выставление отметок
Домашнее задание:
слайд №13
1. Изучить текст учебника по теме “Фосфор”.
2. Сравнить: а) неметаллические свойства азота и фосфора как элементов; б) химическую активность азота и фосфора как простых веществ. Сделайте вывод.
3. Составить формулы веществ, образующих генетический ряд фосфора.
4. Индивидуальные задания. Подготовить сообщения: 1) об истории спичек; 2) о биологической роли фосфора и его соединений.