Урок №
Класс:
ТЕМА. Вода, строение молекулы. Методы определения состава воды – анализ и синтез. Вода в природе и способы ее очистки
Тип урока: комбинированный урок.
Цель урока: сформировать представление о строении молекулы воды, об анализе и синтезе на примере изучения состава воды.
Задачи:
1. Предметные. Знать качественный и количественный состав воды. Уметь объяснять понятия «анализ» и «синтез». Знать способы очистки воды.
2. Метапредметные. Развивать умения устанавливать аналогии, причинно-следственные связи, строить умозаключение и делать выводы, владеть устной речью, формулировать, аргументировать и отстаивать свое мнение.
3. Личностные. Формировать и развивать экологическое мышление и основы экологической культуры, мировоззрение, соответствующее современному уровню развития науки.
Межпредметные связи: биология, география.
Ресурсы урока (оборудование): ноутбук, проектор.
Ход урока
I. Организация класса
1. Приветствие учащихся.
2. Определение отсутствующих.
3. Проверка готовности учащихся к уроку.
II. Проверка домашнего задания
Письменный опрос
III. Актуализация опорных знаний
Перед вами 3 стакана с водой. Подумайте, почему они здесь?
IV. Организация познавательной деятельности
Вода занимает 2/3 поверхности земного шара, и лишь 1/3 приходится на сушу. Вода в океанах, морях, реках, озёрах, под землёй и в почве. Ледники и айсберги - тоже вода, но замёрзшая. Много воды в атмосфере: это облака, туман, пар, дождь, снег. Поэтому с высоты космического пространства наша планета имеет голубой оттенок. Мы не удивляемся обилию воды. На земле она окружает нас всюду. Вода - самое обыденное и в то же время самое удивительное вещество на нашей планете. Она обладает рядом необычных свойств.
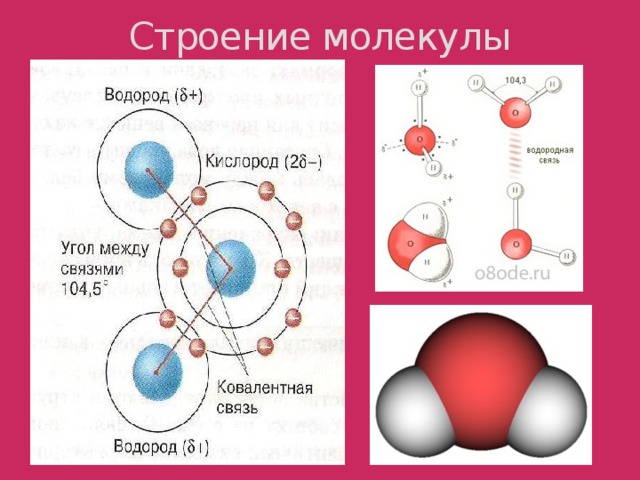
1. Строение молекулы воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода оголяются. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр.
2. Тяжелая вода
Тяжёлая вода (оксид дейтерия) — имеет ту же химическую формулу, что и обычная вода, но вместо атомов водорода содержит два тяжёлых изотопа водорода — атомы дейтерия. Формула тяжёловодородной воды обычно записывается как: D2О или 2H2О. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха.
По своим свойствам тяжелая вода заметно отличается от обычной воды. Реакции с тяжелой водой протекают медленнее, чем с обычной, константы диссоциации молекулы тяжёлой воды меньше таковых для обычной воды.
3. Методы определения состава воды: анализ и синтез.
Получение сложных веществ из более простых называют синтезом (от греч. "синдезис" соединение).
В химии для определения состава веществ и вывода их химических формул пользуются как анализом, так и синтезом. Результаты одного метода проверяются другим.
Вода в природе и способы ее очистки. Вода - самое распространенное на земле вещество. Ею заполнены океаны, моря, озера и реки; пары воды входят в состав воздуха. Вода содержится в организмах животных и растений. Так, например, в организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%.
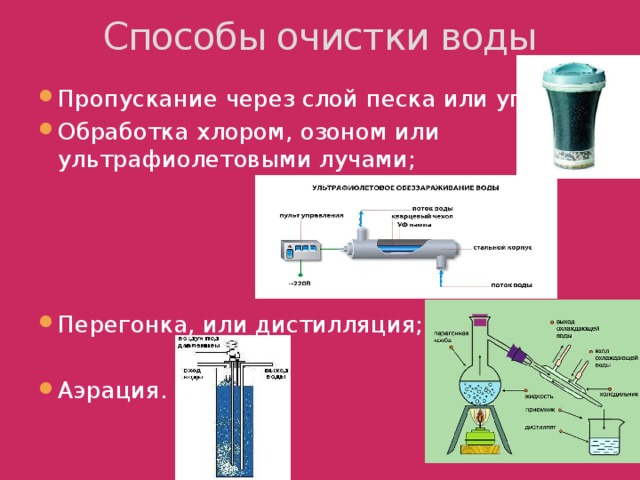
4. Способы очистки воды (слайд 7)
VI. Рефлексия
Как я усвоил сегодняшний материал:
1. Мусорная корзина
2. Чемодан
3. Мясорубка
VII. Домашнее задание
§31