Цель урока: дать понятие, что такое кислоты. Классификация и общие свойства кислот
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
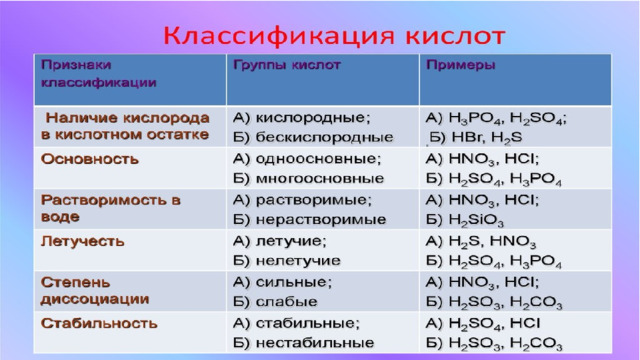
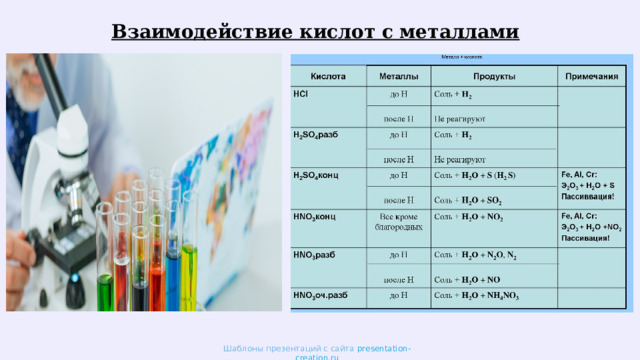
Тема: "Кислоты"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Тема: "Кислоты"»
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
2200 руб.
3140 руб.
1930 руб.
2760 руб.
1990 руб.
2840 руб.
1770 руб.
2530 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства














![Список литератур ы 1. Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение. 2. Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа. 3. Сайт ХиМик [ режим доступа ] //https://xumuk.ru/ 4. Наука в Рунете [ режим доступа ] //https://elementy.ru/catalog](https://fsd.kopilkaurokov.ru/up/html/2023/11/10/k_654e17ad348d9/img_user_file_654e17ae300aa_18.jpg)
















