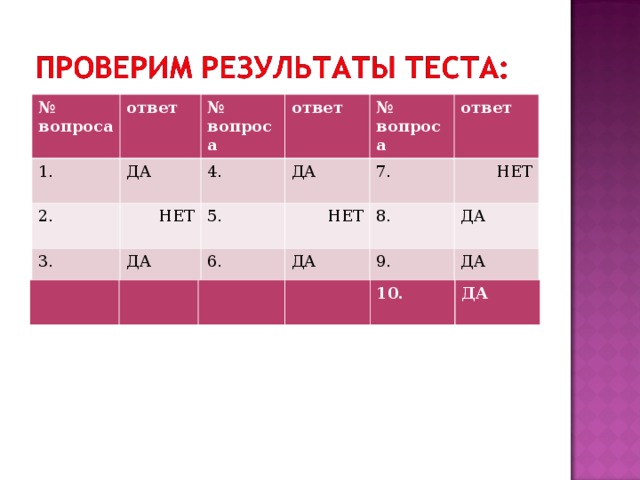
Данная презентация: " Свойства серной кислоты" подготовлена для учащихся 9а класса( к открытому уроку для родителей). В первой части урока учащимся предлагается тест , варианты ответа : да или нет. Ученики оценивают свои знания.самостоятельно - самооценка. Возможна работа в парах. Далее на примере серной кислоты, учащиеся совершенствуют свои знания по теме: Кислоты. Учащиеся выполняют лабораторные опыты, подтверждая теоретические знания на практике. Для учащихся подготовлены инструкции для выполнения практической части . Они знакомятся с качественной реакцией на сульфат ион. По ходу изучения нового материала, учащимся предлагаются фрагменты тестового задания. Домашнее задание альтернативное, на выбор учащегося ( мини -проект, выполнение упражнения. работа с интернет-ресурсами, сообщение по теме).
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
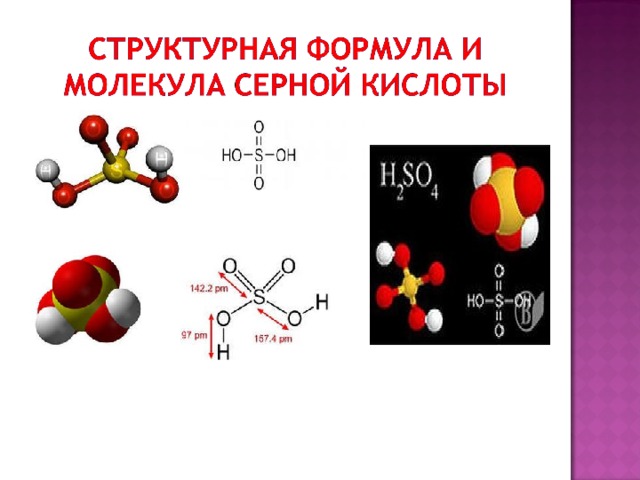
" ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ" -презентация.
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«" ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ" -презентация. »
Полезное для учителя
Распродажа видеоуроков!
2200 руб.
3140 руб.
1770 руб.
2530 руб.
1930 руб.
2760 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства