Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
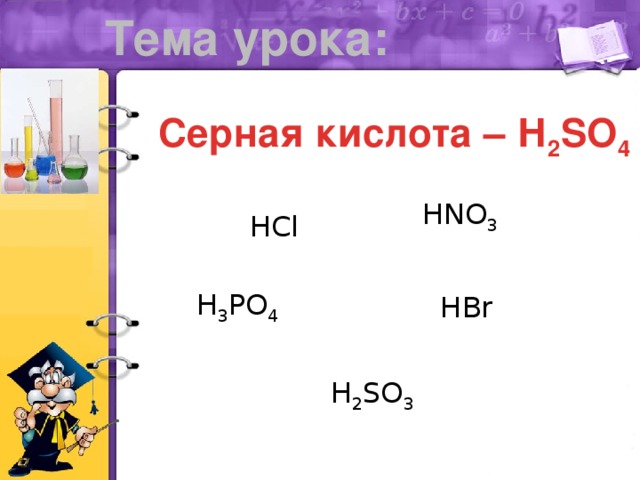
Презентация "Серная кислота"
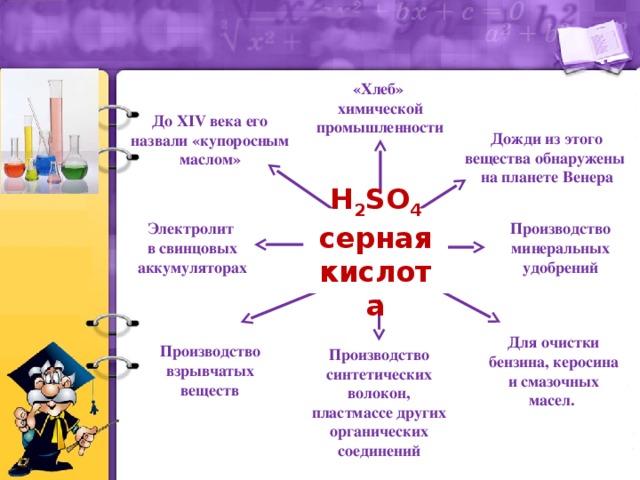
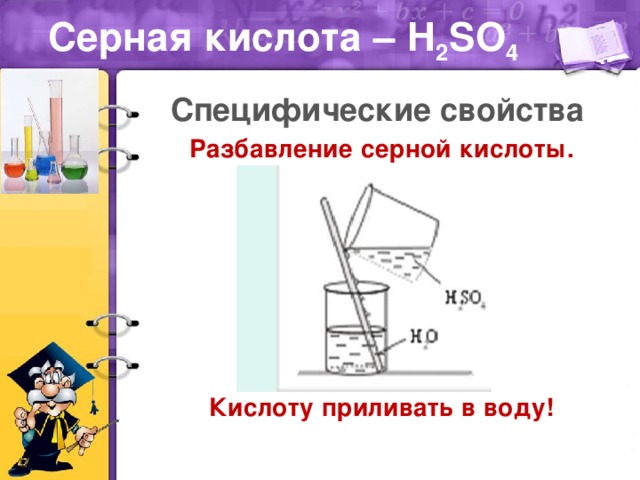
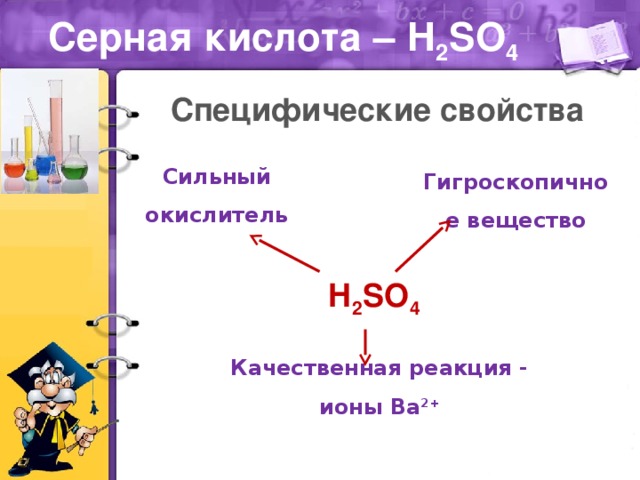
Презентация к уроку по теме "Серная кислота", химия 9 класс. Презентацию можно исрользовать для изучения нового материала или его закрепления. Показаны особенности химических свойств серной кислоты (разбавленной и концентрированной), указаны основные области применения серной кислоты.
Урок направлен на реализацию следующих целей:
Образовательные:
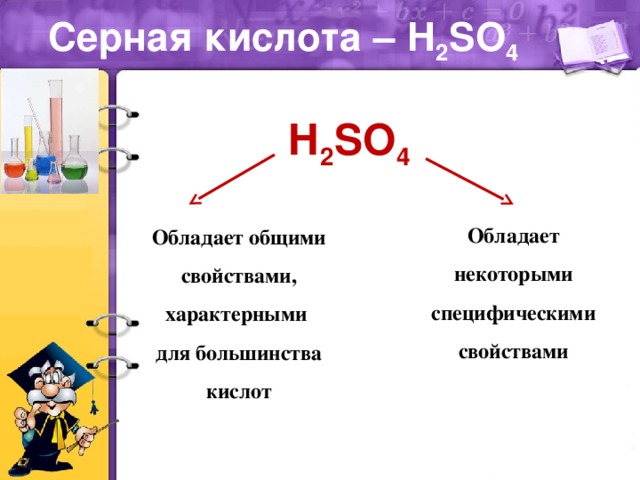
• актуализировать и обобщить знания учащихся о свойствах кислот
• рассмотреть некоторые специфические свойства серной кислоты
Развивающие:
• развить навыки составления уравнений химических реакций;
• умения проводить химический эксперимент, делать выводы;
• развивать логическое мышление учащихся;
• совершенствовать умения доказывать, сравнивать.
Воспитательные:
• повышение интереса к предмету;
• воспитание внимательности, аккуратности при выполнении химического эксперимента;
• соблюдение правил техники безопасности;
• воспитание культуры общения
Тип урока – комбинированный
При организации этого урока использованы следующие методы:
Словесные: рассказ учителя об использование серной кислоты в промышленности, при объяснении особенностей специфических свойств серной кислоты. Беседа с учащимися о свойствах кислот, с опорой на знания из курса химии 8 класса.
Наглядные методы: при объяснении материала в течение урока была использована презентация по теме «Серная кислота», а также видеофрагмент химического опыта.
Практические методы: для доказательства общих свойств серной кислоты, учащиеся выполняли химический эксперимент в мини группах.
Исследовательский метод: был использован группой учащихся, которые проводили химический эксперимент по нахождению серной кислоты среди других веществ в трех пронумерованных пробирках.
Для стимулирования и мотивации работы учащихся на уроке - были подобраны интересные данные о химическом веществе, некоторые исторические и занимательные факты, проведение эксперимента. В течение всего урока учащиеся вовлекались в мыслительные операции – анализа, обобщения, делали выводы.
Материал к уроку был подобран с учетом уровня знаний учащихся 9 класса, считаю, что он был доступно изложен. Показана связь обучения с жизнью – воздействие серной кислоты на органические вещества, соблюдение техники безопасности при работе с кислотами, ее применение в современной промышленности.
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация "Серная кислота" »
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства