Открытый урок по теме: "История открытия строения атома"
Объявление
“Отыщи всему начало и ты многое поймёшь”. (Козьма Прутков.)
Тип урока: урок изучения нового материала.
Цель урока: изучить строение атома.
Задачи:
Образовательные:
- Изучить планетарную модель атома.
- Познакомить учащихся с гипотезой Томсона и фундаментальным опытом Резерфорда.
- Рассмотреть историю открытия нейтрона и создание протонно-нейтронной модели атома.
Развивающие:
- Отработать навыки определения состава атома, состава ядра атома по периодической системе химических элементов.
- Продолжить развитие навыков работы с опорным конспектом, таблицами и схемами.
- Развивать интеллектуальные и творческие способности учащихся.
- Развивать монологическую речь.
- Формировать умение самостоятельно работать с различными источниками, обобщать материал при подготовке проектов.
Воспитательные:
- Развивать познавательный интерес к предметам.
- Показать значение опытных фактов.
- Показать роль крупных ученых в развитии науки.
Оборудование: портреты ученых; таблица периодической системы химических элементов Д.И.Менделеева; фильм “Опыт Резерфорда” (фрагмент); бланк опорного конспекта (у каждого учащегося).
План урока:
- Вступительное слово учителя, постановка целей урока.
- Изложение нового материала.
- Отработка изученного материала.
- Подведение итогов. Домашнее задание.
Новый материал
1.Учитель
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно. Задача нашего урока - совершить экскурс в историю развития взглядов на строение атома, начиная с древних времен до начала 20-го века, познакомиться с фундаментальными экспериментами и теоретическими работами конца 19-го – начала 20-го века, которые перевернули представления об атоме и привели к созданию новой квантовой модели атома.
На волне открытий строения атома поэт Валерий Брюсов в 1922 году написал замечательное стихотворение «Мир электрона»:
-Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
-Еще быть может, каждый атом-
Вселенная, где сто планет,
Там, все что здесь, в объеме сжатом ,
Но так же то, чего здесь нет.
-Их меры малы, но все та же
Их бесконечность, как и здесь
Там скорбь и страсть, как здесь, и даже,
Там та же мировая спесь.
Гипотtза о существовании атомов, тех неделимых частиц, различные конфигурации которых в пустоте образуют окружающий нас объективный мир, так же стара, как и наша цивилизация. Понятие атома существует уже по край ней мере 25 столетий.
Демокрит (460 – 370 гг. до нашей эры) – происходил из богатого и знаменитого рда в Северной Греции. Все доставшиеся в наследство деньги он потратил на путешествия, где приобрел обширные знания. Горожане признали его мудрецом.
Демокрит был убежденным атомистом. Основные элементы его картины природы таковы:
- все тела состоят из атомов, которые неделимы и имеют неизменную форму;
- число атомов бесконечно, число различных типов атомов тоже бесконечно;
-атомы обладают различными выступами, углублениями, крючками, что позволяет им образовывать устойчивые соединения;
-атомы находятся в постоянном движении.
Античный автор Тит Лукреций Кар писал в своей поэме «О природе вещей»:
-Вот посмотри: всякий раз, когда солнечный свет проникает
-В наши жилища и мрак прорезает своими лучами,
-Множество маленьких тел в пустоте, ты увидишь, мелькая
- Мечутся взад и вперед в лучистом сиянии света;
-Будто бы в вечной борьбе они бьются в сраженьях и битвах,
-В схватках бросаются вдруг по отрядам, не зная покоя.
-Может из этого ты уяснишь себе, как неустанно
-Первоначала вещей в пустоте необъятной метутся.
В России теорию о мельчайших частицах вещества развивал Михаил Васильевич Ломоносов. Различая два вида частиц материи, он дает им названия «элементы» - атомы и «корпускулы» - молекулы.
« Элемент есть часть тела , не состоящая из каких-либо других частиц, а «корпускула» есть собрание элементов в одну большую массу»
Так прозвучала мысль о том, что молекула состоит из атомов.
Однако к концу 19-го века появляются неопровержимые факты, которые свидетельствуют о сложном строении атома. Наиболее серьезный удар по привычным представлениям об атомах нанесло открытие электрона – частицы, входящей в состав атома и последовавшая после этого первая попытка создания модели атома.
Итак Джозеф Джон Томсон
Проект представляет Смоленская Влада
30 апреля 1897 года день рождения электрона
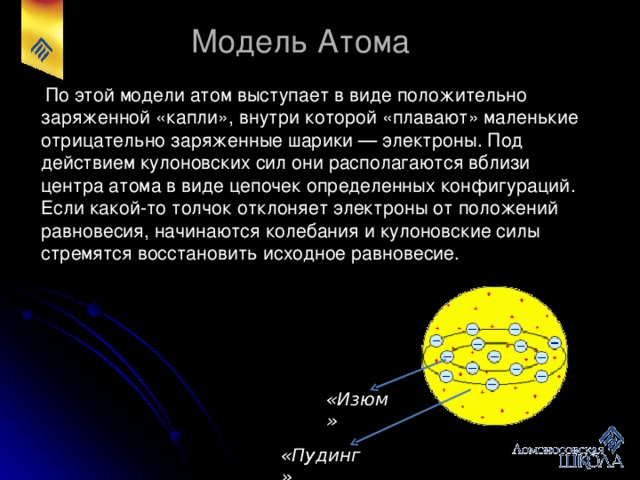
Учащийся. Делает сообщение о модели атома предложенной английским физиком Дж. Дж. Томсоном: “Атом” в переводе с греческого - неделимый. Но после открытия в 1897 г. электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом. Предполагалось, что их очень много. В целом атом электронейтраллен. Для устойчивости атома необходимо, чтобы электроны располагались концентрическими слоями, в каждом слое определенное число электронов. Томсон с помощью данной модели объяснил ряд физических явлений. Например, хорошая проводимость металлов объяснялась тем, что атомы металлов легко теряют часть электронов.
Первая модель атома сыграла положительную роль: в дальнейшем была использована верная идея о слоях электронов в атоме, о потере электронов атомами. Однако скоро обнаружилось несоответствие модели реальной действительности. В частности, модель атома Томсона оказалась в противоречии с результатами опыта Резерфорда”.
2.Учитель
Однако скоро обнаружилось несоответствие данной модели атома действительности. В частности, модель атома Томсона оказалась в противоречии с результатами опытов Эрнеста Резерфорда – одним из основателей, атомной и ядерной физики, члена Лондонского королевского общества, почетного члена 30 академий и научных обществ, в том числе Академии наук СССР.В 1908 году – лауреат Нобелевской премии за исследования радиоактивности. Его учениками были Чедвик, Бор, Петр Капица.
Петр Капица писал: «Я не могу вспомнить другого ученого современника Резерфорда, в лаборатории которого воспитывалось бы столько крупных физиков. История науки показывает, что крупный ученый – это не обязательно большой человек, но крупный учитель не может не быть большим человеком!»
Эрнест Резерфод
Проект представляет Иваночкина Анна
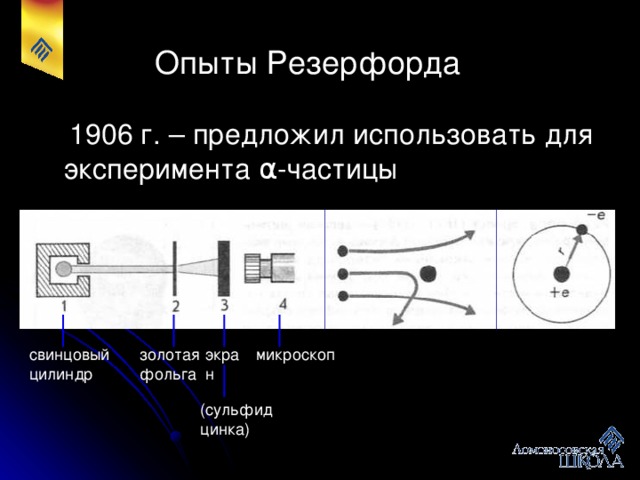
Учащийся. Делает пояснения о планетарной модели атома, вытекающей из опытов Э.Резерфорда. В 1909 - 1911 гг. Резерфорд экспериментально доказал, что у атомов есть ядра. В мае 1911 г. на страницах лондонского “философского журнала” он изложил результаты экспериментальных и теоретических поисков в области строения атома. Ядро занимает в атоме ничтожную часть объема, оно положительно заряжено, и в нем сосредоточена почти вся масса атома, так как электроны по сравнению с атомом очень легкие частицы. Электроны движутся вокруг ядра.
Альфа-частицы от радиоактивного источника, пройдя через диафрагму, попадают на тонкую фольгу из золота. Она имеет толщину около микрона, т.е. состоит приблизительно из 3000 атомных слоев. Большая часть альфа-частиц легко проходит через фольгу, мало отклоняясь. Но некоторые, редкие альфа-частицы отклоняются на значительные углы и даже на углы, близкие к 180°, т.е. отбрасываются назад.
Результаты опыта можно объяснить следующим образом. Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота. Это возможно потому, что легкие электроны почти не влияют на движение тяжелой альфа-частицы. Так как они в большинстве случаев отклоняются на малые углы, атомы в большей части своего объема заполнены электронами и лишь небольшую их часть занимает положительно заряженное вещество. Эта центральная часть атома получила название ядра. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит. По соотношению между общим числом частиц и числом отклонившихся на определенные углы частиц рассчитывается размер ядра и заряд ядра. Оказалось, что радиус ядра имеет порядок 10 - 12 см (10 - 14 м). Заряд же ядра положителен и определяется формулой Q = Z•e, где Z - порядковый номер элемента в периодической системе, а е- модуль заряда электрона.
Строение всех атомов зашифровано в периодической системе химических элементов. Порядковый номер химического элемента показывает электрический заряд ядра атома Z , этот заряд численно равен сумме протонов в ядре атома; т.к. атом в целом электрически нейтральная частица, то суммарный положительный заряд атома равен суммарному отрицательному заряду всех электронов. Заряд – основной признак, определяющий химический элемент. Необходимо было обладать большой научной интуицией, чтобы, не зная состава атомного ядра, взять за основу систематизации элементов массу их атомов и открыть в марте 1869 года периодический закон Д.Д. Менделеева.
Учитель
Если мы вспомним стихотворение В. Брюсова, которое прозвучало в начале нашего урока, то там были строки, где автор сравнивает атом с Солнечной системой.
1 Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
2 Еще, быть может, каждый атом -
Вселенная, где сто планет,
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет.
3 Их меры малы, но все та же
Их бесконечность, как и здесь,
Там скорбь и страсть, как здесь, и даже
Там та же мировая спесь
4 Их мудрецы, свой мир бескрайний
Поставив центром бытия,
Спешат проникнуть в искры тайны
И умствуют, как ныне я
5 А в миг, когда из разрушенья
Творятся точки новых сил.
Кричат, в мечтах самовнушенья.
Что Бог свой светоч загасил!
3.Учитель
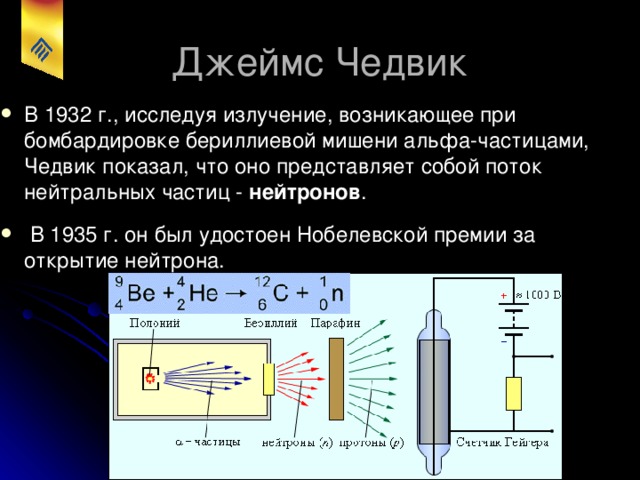
Термин «нейтрон» появился гораздо раньше открытия самой частицы. Под ним подразумевали некую нейтральную структуру материи. Идея о существовании нейтрона витала в воздухе и никто не знал какое обличие он должен принять.
Джеймс Чедвик получил Нобелевскую премию за «открытие нейтрона»
Свой проект представляет Федосов Дмитрий
Открытие нейтрона - ключ к ядерной физике. Деление ядер урана под действием нейтрона «потрясающее» и «зловещее» открытие.
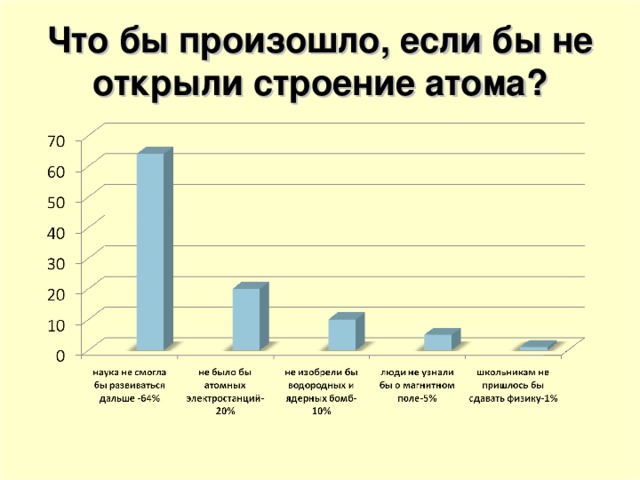
Значение открытия атома исследовали Велигодская Дара и Дружина Дарья
И в заключении хочу прочитать вам стихотворение, которое написала ученица 10 класса Шульпина Дарья
Домашнее задание по физике: § 94 , работая дома с учебником, заполнить бланк опорного конспекта. Предлагаем ребятам по желанию творческое задание (записано на доске):
Сочинить историю в любом жанре (сказка, басня, детектив и т.д.): на что по-вашему похож атом?