| Давайте сейчас разгадаем, что же мы будем повторять? 1.«Их получают путем горения
Или сложных веществ разложения.
В них два элемента, один – кислород.
Я отнесу к ним и известь, и лед».
2. «Они имеют кислый вкус.
В них изменяет цвет лакмус.
А если активный металл попадет,
Получим мы соль и еще водород». 3. «В каких веществах у фенолфталеина,
Бывает не жизнь, А сплошная малина?» 4. «Хлориды и нитраты,
Сульфаты, карбонаты
Я без труда и боли,
Объединю в класс...» (На доске схема, которая заполняется по мере ответов.)  Оксиды, кислоты, щелочи соли Оксиды, кислоты, щелочи и соли это…? Итак, что мы сегодня на уроке будем повторять?
| Ученики разгадывают загадки.
Оксиды
Кислоты
Щелочи
Соли
Это классы неорганических соединений. «Важнейшие классы неорганических соединений»
| Познавательные Умение структурировать свои знания по определенной теме, ориентироваться в системе своих знаний. Коммуникативные Сотрудничество в поиске и сборе информации.
|
| А теперь предлагаю вам просмотреть видеоролик о воде. К какому классу веществ относится вода? Какие вещества называются оксидами?
Приведите классификацию оксидов. Ваши знания об оксидах мы проверим экспериментально. Но перед тем как выполнять опыты, мы вспомним технику безопасности при работе с химическими веществами. Как надо обращаться с химическими веществами при выполнении работ? Что надо делать при попадании кислот и щелочей на кожу? Как правильно закреплять и держать пробирку при нагревании жидкости? И так для выполнения эксперимента я приглашаю Оксану. Надо доказать, что СаО – основный оксид, а СО2 – кислотный оксид.
Как доказать, что получился гидроксид ?
Что произошло во второй реакции?
Камилла, запиши уравнения реакций на доске, пожалуйста, остальные запишите в тетрадях.
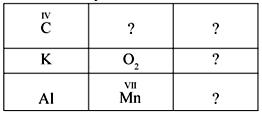
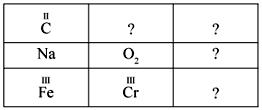
Самостоятельная работа на составление формулы оксидов. Учитель раздает карточки. См. Приложение 1 Формулы оксидов вписываются в клеточки с вопросительными знаками, по принципу «крест-накрест», например формулу оксида углерода(IV) необходимо писать в нижней правой клетке, а оксида марганца – в верхней второй клетке. После завершения работы – устная проверка ответов: Назовите формулу оксида углерода (IV). Назовите формулу оксида марганца(VII). Назовите формулу оксида калия. Назовите формулу оксида алюминия. Повторение свойств оснований А теперь, ребята, понаблюдаем за моими действиями. (Учитель показывает опыт взаимодействия кальция с водой ) Ребята, напишите уравнение реакции: Ребята, а как Оксана получила гидроксид кальция? Таким образом, как мы можем получить гидроксид кальция? Но гидроксид – начало названия,
А класс веществ – основания. Какие вещества называются основаниями?
Вспомните классификацию оснований .
Основания и их свойства Ребята, растворимые основания или щелочи у нас есть в лаборатории, нам их присылают. А вот нерастворимых оснований готовых нет. Мы их получаем сами, проводим опыты. Ваша задача – получить Cu(ОН)2. Я, конечно, могу вам немного подсказать теоретически... У меня здесь спрятана запись уравнения реакции получения Cu(ОН)2. Ой, кто-то стер часть записи, что же делать? ... + ... = Сu(ОН)2 + ... Нужно восстановить запись.
И получить практически из веществ, данных в пробирках Сu(ОН)2.
Проводится самостоятельная работа в парах. См. Приложение 2. А теперь, давайте проверим устно.
Повторение свойств кислот Дайте определение кислотам, пожалуйста.
Как классифицируются кислоты?
Свойства кислот Проведем небольшую исследовательскую работу. Перед вами три пронумерованные пробирки. Вам надо определить, в какой пробирке находится кислота. (Набор реактивов NaOH, H2SO4, Н2О, метилоранж.) Значит какая среда в кислотах? Соли. Если в кислоте атом водорода заменить на атом металла, то что получится? Напишите формулы веществ, которые получаются при взаимодействии натрия и кальция с кислотами серная, угольная, соляная, бромоводородная, азотная, фосфорная, сероводородная, кремниевая. Что такое соли?
Как классифицируются соли?
Давайте решим задачу. Ученые подсчитали, что человек в день употребляет 12–15 г поваренной соли. Сосчитайте, сколько соли вы потребляете за месяц, за год. Сколько соли вы съели за свою жизнь (14 лет).
А сейчас, давайте послушаем сообщение, которое нам приготовил Андрей. | Учащиеся смотрят видеоролик. - Оксиды.
- Сложные вещества, состоящие из 2х элементов, один из которых кислород. - Оксиды бывают основные, кислотные.
Не трогать вещества без разрешения учителя. Смыть большим количеством воды. Пробирка должна быть зажата в лапке так, чтобы ее можно было передвигать, но не выпадала. Проводятся опыты оксида кальция с водой, с оксидом углерода (IV) и гидроксидом кальция. (Ученики наблюдают за проведением опыта)  CaO + H2O Ca(OH)2 CaO + H2O Ca(OH)2
Добавляем фенолфталеин, раствор окрасился в малиновый цвет. Значит CaO Основный оксид.   Ca(OH)2 + CO2 CaCO3 Ca(OH)2 + CO2 CaCO3 Выпал осадок, значит кислотные оксиды реагируют с основаниями. Учащиеся записывают уравнения реакции в тетрадях)
Ученики заполняют таблицы.
CO2 Mn2O7 K2O Al2O3
 Ca +H2O Ca(OH)2 Ca +H2O Ca(OH)2 При взаимодействии оксида кальция с водой. Мы можем получить гидроксид кальция при взаимодействии кальция с водой и при взаимодействии оксида кальция с водой.
Основания – это сложные вещества , состоящие из атомов металлов и одной или несколько гидроксогрупп. Растворимые и нерастворимые.
Один ученик восстанавливает запись на доске CuSO4 +2NaOH = Сu(ОН)2 + H2O Проделывают лабораторный опыт взаимодействия CuSO4 с NaOH
Выполняют работу.
Нерастворимые основания(щелочи): Cu(OH)2, , Fe(OH)3, Al(OH)3. Растворимые основания: NaOH, LiOH, Ca(OH)2,
Кислоты – это сложные вещества, состоящие из атомов металлов и кислотных остатков. По составу кислоты делятся на кислород содержащие и бескислородные, а по числу атомов водорода на одноосновные, двухосновные и трехосновные.
Проделывают лабораторный опыт. Из контрольных пробирок отливают в рабочие пробирки растворы веществ и добавляют раствор метилоранжа. В пробирке в которой раствор окрасился в розовый цвет, находится кислота - H2SO4 Кислоты имеют кислую среду.
Соль.
Учащиеся пишут формулы солей в тетрадях, а затем по одному пишут формулы на доске и сверяют.
Соли – это сложные вещества , образованные атомами металлов и кислотными остатками. Соли классифицируются по кислотным остаткам: хлориды, сульфаты и т. д. Ученики проводят подсчеты, проверяют вместе с учителем. За месяц: 15 г•30 = 450 г, за год: 450 г•12 = 5,4 кг, за 14 лет: 5,4 кг•14 = 75,6 кг.
Андрей рассказывает о значении солей. См. Приложение 3
| Личностные Владение правилами безопасного обращения с химическими веществами и оборудованием. Регулятивные Организация рабочего места при выполнении химического эксперимента. Коммуникативные Задавать вопросы, необходимые для организации собственной деятельности и сотрудничества с партнёром. Умение слушать и слышать друг друга.
Познавательные Проведение опытов, подтверждающих химические свойства неорганических соединений, с соблюдением правил техники безопасности. Проведение наблюдений и описание признаков и условий течения химических реакций. Решение задачи.
|
| Физкультминутка «Найди себе пару» Учащимся раздаются карточки с формулами и с названиями веществ различных классов неорганических соединений. Они должны найти соответствующее название или формулу вещества. Генетическая связь между основными классами неорганических соединений. Повторив свойства и способы получения этих веществ, какой вывод вы можете сделать.
Теперь мы с вами подведем итоги. Какая связь существует между основными классами неорганических соединений? Задание: Написать уравнения реакций генетической цепочки: 1 группа - кальция, 2 группа – углерода, 3 – группа – меди, 4 группа – серы.
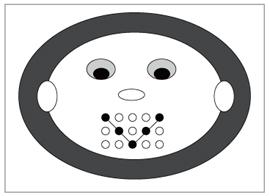
И для закрепления того, что мы с вами прошли, выполним тест. В задании по вариантам выберите правильный ответ. Обведите красной ручкой или фломастером соответствующие точки на рисунке. А теперь эти точки соедините линией. Затем поднимите свои работы и покажите мне их. См. Приложение 5. Спасибо всем за ваши улыбки. Вижу , что с заданием вы справились. |
Обучающиеся встают из-за парт и выполняют задание: Оксид натрия – Na2O Серная кислота – H2SO4 и т.д.
Вещества, относящиеся к разным классам неорганических соединений, связаны друг с другом. Взаимосвязь веществ разных классов отражают генетические ряды.
«Генетическая связь».
Далее 1 и 2, 3 и 4 группы совместно соединяют генетические ряды и пишут формулу соответствующей соли.
   Ca CaO Ca(OH)2 Ca CaO Ca(OH)2  CaCO3 CaCO3   C CO2 H2CO3 C CO2 H2CO3
Ученики выполняют тест. Приложение 4.
Ученики отмечают свои ответы на рисунке. См. Приложение 5 Показывают картинки. | Коммуникативные Проявление готовности к сотрудничеству. Познавательные Умение структурировать свои знания по определенной теме, ориентироваться в системе своих знаний. Умения характеризовать вещества по составу, строению и свойствам, установление причинно-следственных связей между данными характеристиками вещества. Регулятивные Умение самостоятельно контролировать своё время и управлять им.
|
 CaO + H2O Ca(OH)2
CaO + H2O Ca(OH)2 
 CaCO3
CaCO3