|  | ОГАОУ СПО «Белгородский правоохранительный колледж имени Героя России В.В. Бурцева» |
Открытое занятие
по химии по теме:
Тема: «Дисперсные системы»
Богачева Е.В.., преподаватель химии

Белгород, 2015
Учебное занятие по теме: «Дисперсные системы»
Цель урока: Познакомить учащихся с различными видами дисперсных систем, их структурой. Рассмотреть причины коагуляции коллоидных растворов и значение этого явления, роль дисперсных систем в природе и производственных процессах.
Основные понятия: Дисперсная система, дисперсная фаза, дисперсная среда, суспензия, эмульсия, коллоидный раствор, коагуляция, золь, гель.
Планируемые результаты обучения:
Уметь разъяснять смысл понятия «дисперсная система», характеризовать свойства различных видов дисперсных систем, указывать причины коагуляции коллоидов и значение этого явления, решать задачи на приготовление раствора с заданной массовой долей растворённого вещества.
СТРУКТУРА И ХОД УРОКА
| № | Этап урока | Деятельность педагога (с указанием действий с ЭОР, например, демонстрация) | Деятельность студента |
| 1 | Организационный | Организация начала урока, концентрация внимания, создание положительного эмоционального настроя | Проверка готовности к уроку |
| 2-3 | Формирование мотивации, актуализация опорных знаний | Постановка проблемной задачи | Слушают, делают предположения, что нужно рассмотреть на уроке для ответа на проблемный вопрос |
| 4 | Формулирование темы урока | Окончательная формулировка темы урока | Пытаются сформулировать вопросы для изучения |
| 5 | Изучение нового материала с использованием ЭОР | Демонстрация ресурсов ЭОР, объяснение | Слушают, смотрят, делают краткие записи |
| 6 | Закрепление полученных знаний | Предлагает задания для самостоятельной работы, решение задач и кроссворда | Самостоятельная работа с проверкой по эталону |
| 7 | Подведение итогов урока, сообщение и комментирование домашнего задания | Задает наводящие вопросы | Записывают домашнее задание. |
Ход урока:
1.Преподаватель: Сегодня на уроке мы познакомимся с дисперсными системами, их разновидностями и значением. При объяснении нового материала мне помогут учащиеся, получившие опережающее задание. Они самостоятельно изучили тему «Дисперсные системы» и подготовили компьютерные презентации по этой теме.. 2.При изучении неорганической химии вы приобрели первые представления о растворах и процессе растворения веществ в воде. Вы уже знаете, что при смешивании веществ с водой образуются однородные системы и неоднородные системы. Задумывались ли вы, почему одни вещества с водой образуют однородную систему. А другие – неоднородную?
3.Демонстрация: Стаканчик 1-соль с водой и стаканчик 2-мел с водой.
Подвожу итог:
Действительно, соль с водой – истинный раствор, а мутная жидкость (мел с водой)- дисперсная система, называемая суспензией.
Чтобы ответить на этот вопрос, следует выяснить, что происходит в процессе растворения веществ в воде. При растворении вещества измельчаются – дробятся. Диспергирование означает раздробление, размельчение.
4.Формулирование темы урока, целей и задач урока
5.Дисперсная система- это система, компоненты которой равномерно распределены один в другом. (диктую определения, учащиеся записывают).
Дисперсной фаза- мелкораздробленное вещество, которое равномерно распределено в однородной среде.
Дисперсная среда- однородное вещество, в котором распределена дисперсная фаза.
Дисперсных систем известно много. Они различаются между собой в зависимости от того, какие частицы (твёрдые, жидкие, газообразные) и в какой среде (жидкой, газообразной) распределены. Давайте посмотрим 1презентацию и постараемся понять классификацию дисперсных систем.
(презентация 1 с комментариями) .
Итак, это классификация ДС в зависимости от агрегатного состояния дисперсной фазы и дисперсной среды. А по каким ещё признакам можно классифицировать ДС? (ответы детей) - Размеры дисперсных частиц.
Запись на доске: Классификация по размеру дисперсной фазы.


 Грубодисперсные
Грубодисперсные

Д

 исперсные системы Тонкодисперсные (коллоиды)
исперсные системы Тонкодисперсные (коллоиды)
Ист. Растворы
(часть схемы учащиеся заполняют самостоятельно, после просмотра. Проверить!!!)
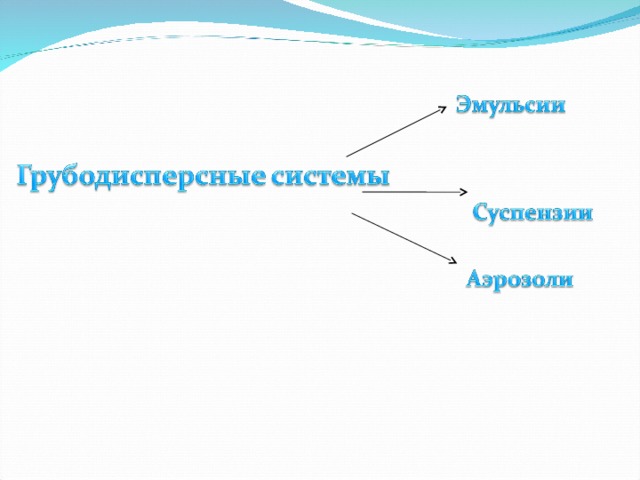
О грубодисперсных системах (презентация 2 с комментариями)
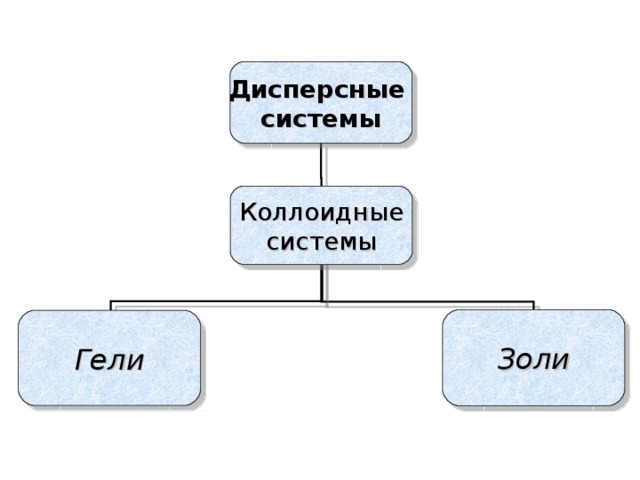
Итак, тонкодисперсные системы делятся….. на золи и гели ( заполнение схемы учащимися). Гели в свою очередь тоже делятся… (презентация 3 с комментариями)
Подведём итоги увиденного и услышанного, (записи терминов тетради):
Грубодисперсные системы (размеры частиц больше 100 нм) делятся на суспензии, эмульсии и аэрозоли.
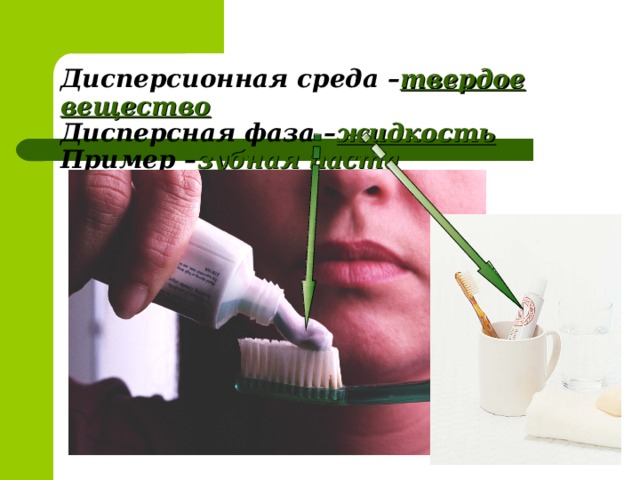
Суспензия – это ДС, в которой дисперсной фазой является твёрдое вещество, а дисперсной средой - жидкость, причём твёрдое вещество нерастворимо в жидкости (краска, побелка, пасты, кремы, мази) показ стаканчика 2- это суспензия. Прошло немного времени, и мел осел на дно стакана – под действием силы тяжести частицы твёрдого вещества седиментировали.
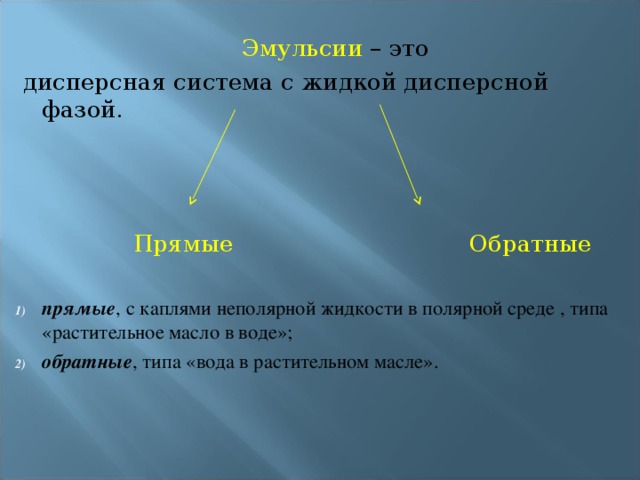
Эмульсия – это ДС, в которой дисперсной фазой и дисперсной средой являются взаимно не смешивающиеся жидкости ( молоко, нефть, лекарственные и косметические средства)- показ эмульсий.
Аэрозоль – это грубодисперсная система, в которой дисперсионной средой является газ (например, воздух), а дисперсной фазой- жидкость(облака, радуга, выпущенный из баллончика лак для волос или дезодорант)- показ или частицы твёрдого вещества (пылевое облако).
Грубодисперсные системы легко осаждаются, частицы веществ задерживаются обычными фильтрами, например фильтровальной бумагой.
Тонкодисперсные системы или коллоидные системы (размеры частиц от1до 100 нм) занимают промежуточное положение между грубодисперсными системами и истинными растворами делятся на золи и гели.
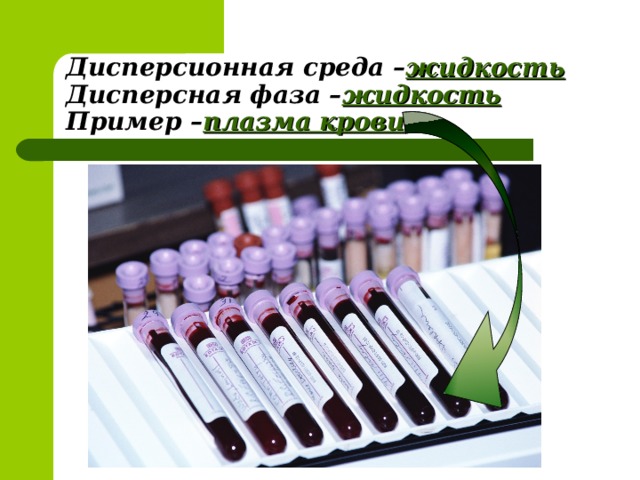
Золи - это коллоидные системы, в которых дисперсионной средой является жидкость, а дисперсной фазой - твёрдое вещество (цитоплазма, кровь . лимфа). Отдельные частицы золя изолированы друг от друга дисперсионной средой. С течением времени они могут укрупняться, сталкиваясь друг с другом. Такое явление получило название коагуляции. Кроме коагуляции, при длительном хранении золи могут превращаться в гели - особое студнеобразное коллоидное состояние( желе, холодец ,гель для волос)- показ. Для некоторых гелей характерно явление синерезиса (расслоения) – самопроизвольного выделения жидкости. Чаще всего с явлением синерезиса приходится бороться, посколько именно оно определяет сроки годности пищевых, косметических, медицинских гелей. Необходимо внимательно следить за сроком годности для безопасного использования того или иного геля. Например, при длительном хранении мармелад или торт «Птичье молоко» выделяет жидкость, становится непригодным к использованию. Однако в некоторых случаях синерезис - великое благо. Благодаря биологическому синерезису мы наблюдаем такое явление, как свёртывание крови, суть которого состоит в превращении растворимого белка фиброгена в нерастворимимый – фибрин. Коллоидные растворы широко распространены в природе и играют важную роль в жизненных процессах. Так, например, яичный белок, плазма крови представляют собой коллоидные растворы, в которых осуществляются физиологические процессы. В состав любого живого организма входят твёрдые, жидкие и газообразные вещества, находящиеся в сложнейших взаимоотношениях друг с другом и окружающей средой. Цитоплазма клеток обладает свойствами, характерных как для жидких, так и студнеобразных веществ. С химической точки зрения организм в целом – это сложная совокупность многих коллоидных систем. Не меньшее значение имеют коллоидные растворы почвы.
Характерное свойство коллоидных растворов – их прозрачность. В этом они сходны с истинными растворами. Но если пропустить луч света через эти растворы, то можно обнаружить их отличие: через прохождение луча через коллоидный раствор появляется светящийся конус (рис. 88 в учебнике), т.к. коллоидные частицы крупнее частиц в истинных растворах и поэтому способны рассеивать проходящий свет-эффект Тиндаля (работа с учебником). На схеме- размеры частиц в истинных растворах меньше 1 нм.
Итак, знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе. Мы сталкиваемся с ними в повседневной жизни. (презентация 4)
6.Давайте обобщим и повторим, всё, что вы сегодня услышали. Сейчас я раздам карточки с заданиями разного уровня, 1 уровень- самый лёгкий, надо заполнить пропуски в таблице, 2 уровень- сложнее, необходимо найти соответствие, 3 уровень- творческий – надо заполнить кроссворд. Работать будете в группах. На работу даётся 10 минут и результаты проверят учащиеся- эксперты. (Приложение1)
Преподаватель: количественной характеристикой ДС является такое понятие, как массовая доля.
Различают массовую долю компонента в смеси, которую находят по формуле:
 m(компонента) . 100%
m(компонента) . 100%
ω (компонента) = m(смеси)
Объёмная доля компонента в газовой смеси:
 φ(компонента)= V(компонента) . 100%
φ(компонента)= V(компонента) . 100%
V(смеси)
Массовая доля растворённого вещества:
ω (растворённого вещества)= m(растворённого вещества) .100%
 m(раствора)
m(раствора)
Рассмотрим решение некоторых типовых задач, имеющих практическое значение.
Задача: Сколько нужно взять хлорида натрия и воды, чтобы приготовить 300г физиологического раствора с массовой долей 0,9%?
(показ решения задачи на доске)
Задачи на растворы мы решали ранее и сейчас вы попробуете решить подобные задачи. (раздаю карточки с разноуровневыми задачами-Приложение2)
7.Оценки за урок,
Домашнее задание (задачи, если не успели решить), параграф 11
Приложение 1
Самостоятельная работа
по теме «Дисперсные системы»
Уровень I
Задание: заполните пропуски в таблице.
Примеры дисперсных систем
| Дисперсная система | Дисперсная среда | Дисперсная фаза |
| Туман |
| Вода |
|
| Воздух | Частички сажи |
| Молоко | Вода |
|
| Масло |
| Вода |
| Известковая вода |
| Частички извести |
Уровень I I
Задание: найдите соответствие между колонками в таблице
| Понятие | Определение |
| 1.Дисперсная система | Г) Дисперсная система, в которой дисперсной фазой является твёрдое вещество, а дисперсной средой –жидкость, причём твёрдое вещество нерастворимо в жидкости |
| 2.Дисперсная фаза | Б) Дисперсная система, в которой дисперсной фазой и дисперсной средой являются взаимно не смешивающиеся жидкости |
| 3.Дисперсная среда | Д) Однородное вещество, в котором распределена дисперсная фаза |
| 4.Суспензия | А) Система, компоненты которой равномерно распределены один в другом. |
| 5.Эмульсия | Е) Способность коллоидных растворов рассеивать свет. Этим коллоидные растворы отличаются от истинных |
| 6.Коллоидный раствор | Ж) Неоднородная система, состоящая из двух фаз с сильно развитой поверхностью раздела между ними. Размеры коллоидных частиц меньше, чем дисперсной фазы в суспензиях и эмульсиях, но больше, чем в истинных растворах. |
| 7.Эффект Тиндаля | В) Мелкораздробленное вещество, которое равномерно распределено в однородной среде |
Уровень III
Задание: заполните кроссворд
КРОССВОРД
«ДИСПЕРСНЫЕ СИСТЕМЫ».
|
| 1 С |
|
|
|
|
|
|
| 2
|
И |
|
|
|
|
|
|
|
|
|
| 3
|
|
|
|
Н |
|
| 4
|
|
|
|
Е |
|
|
|
|
|
|
| 5
|
|
Р |
|
|
|
|
|
|
|
| 6
|
Е |
|
|
|
|
| 7 З |
|
|
|
|
| 8
|
|
|
|
|
|
|
|
И |
|
|
|
| 9
|
|
|
|
|
С |
|
|
|
|
|
|
|
|
|
1.Однородное вещество, в котором распределена дисперсная фаза.
2.Природная эмульсия, основная часть растительной или животной клетки.
3.Природная дисперсная система, где дисперсная среда – газ,
а дисперсная фаза – жидкость.
4.Грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсной средой.
5.Дисперсная система, в которой дисперсной средой является газ, дисперсной фазой – жидкость, применяется в парфюмерии.
6.Особое студнеобразное коллоидное состояние вещества.
7.Коллоидная система, в которой дисперсная среда – жидкость, а дисперсная фаза – твёрдое вещество.
8.Явление слипания коллоидных частиц.
9.Дисперсная система, в которой дисперсная среда и дисперсная фаза – жидкости, которые не смешиваются друг с другом.
Ключевое слово – самопроизвольное выделение жидкости (расслоение) в гелях.
Приложение 2
Решение задач по теме «Растворы»
Вариант1
1.▲В 120г. воды растворили 30г вещества. Массовая доля вещества в полученном растворе составляет:
А) 25% Б) 20% В) 30%
2.■В 120 мл (ρ=1,2 г/мл) 15% раствора вещества растворили ещё 12 г этого вещества. Массовая доля вещества во вновь полученном растворе:
А) 28% Б) 23.3% В) 28%
3.*Слили два раствора одного и того же вещества: 160г 15% и 140 12%. Массовая доля вещества во вновь полученном растворе:
А) 29,1% Б) 25,5% В) 13,6%
Вариант 2
1.▲В 120г. 10% раствора растворили ещё 12г вещества. Массовая доля вещества в полученном растворе составляет:
А) 20% Б) 15,6% В) 30%
2.■Из 180 мл 25% раствора вещества (ρ=1,1 г/мл) выпарили 20 мл воды. Массовая доля вещества во вновь полученном растворе:
А) 27,8% Б) 25% В) 30,9%
3.* В 712,2 мл 5% раствора соляной кислоты(ρ=1,025 г/мл) растворили 33,6 л хлороводорода. Массовая доля вещества во вновь полученном растворе:
А) 9,3% Б) 11,5% В) 12,6%
Вариант1
1.▲В 120г. воды растворили 30г вещества. Массовая доля вещества в полученном растворе составляет:
А) 25% Б) 20% В) 30%
2.■В 120 мл (ρ=1,2 г/мл) 15% раствора вещества растворили ещё 12 г этого вещества. Массовая доля вещества во вновь полученном растворе:
А) 28% Б) 23.3% В) 28%
3.*Слили два раствора одного и того же вещества: 160г 15% и 140 12%. Массовая доля вещества во вновь полученном растворе:
А) 29,1% Б) 25,5% В) 13,6%
Вариант 2
1.▲В 120г. 10% раствора растворили ещё 12г вещества. Массовая доля вещества в полученном растворе составляет:
А) 20% Б) 15,6% В) 30%
2.■Из 180 мл 25% раствора вещества (ρ=1,1 г/мл) выпарили 20 мл воды. Массовая доля вещества во вновь полученном растворе:
А) 27,8% Б) 25% В) 30,9%
3.* В 712,2 мл 5% раствора соляной кислоты(ρ=1,025 г/мл) растворили 33,6 л хлороводорода. Массовая доля вещества во вновь полученном растворе:
А) 9,3% Б) 11,5% В) 12,6%




 Грубодисперсные
Грубодисперсные


 исперсные системы Тонкодисперсные (коллоиды)
исперсные системы Тонкодисперсные (коллоиды)
 φ(компонента)=
φ(компонента)=