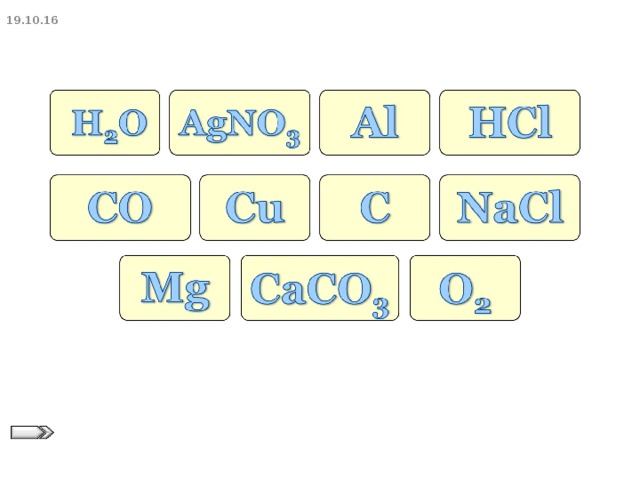
урок химии по теме "Простые и сложные вещества. Относительная атомная масса. Относительная молекулярная масса." Целями данного урока являются знать состав простых и сложных веществ; уметь различать простые и сложные вещества; знать основные понятия "химическая формула", "индекс", "коэффициент", "относительная атомная масса", относительная молекулярная масса"; уметь вычислять массы элементов. Разработка урока содержит тренинг "Ассоциация имен", игру "Да - нет", для закрепления изученного имеются индивидуальные задания. Презентация содержит для повторения изученного материала "Химическую разминку", мини - тест с ключами ответов, новый материал для изучения темы, задания для закрепления изученного.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Урок химии 8 класс "Простые и сложные вещества. Относительная атомная масса." + презентация
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Простые и сложные вещества Относительная атомная масса»
Просмотр содержимого презентации
«простые в-ва. относит ат масса»
Полезное для учителя
Распродажа видеоуроков!
1660 руб.
2760 руб.
1700 руб.
2840 руб.
1880 руб.
3140 руб.
1520 руб.
2530 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства