Конспект урока по химии
Типы химических реакций
8 класс
Учитель химии: Мелихова Тамара Ивановна
Тип урока: урок обобщения и закрепления полученных знаний.
Цель урока: на основе имеющихся у обучающихся знаний об условиях, признаках протекания химических реакций обеспечить усвоение обучающимися понятия классификации химических реакций, деления их на типы (слайд 2)
Задачи:
Закрепить понятие «признаки химических реакций»; типы химических реакций
Развить навыки проведения химических реакций, используя правила техники безопасности; развить логическое мышление при определении типа химической реакции;
Развить познавательную активность и творческие способности обучающихся при выполнении заданий.
Воспитывать отношение к химии, как прикладной науке, при изучении применения ряда химических реакций.
ХОД УРОКА
Вводное слово учителя.
Самое интересное в окружающем нас мире – это то, что он очень сложно устроен, и к тому же постоянно меняется. Каждую секунду в нем происходит неисчислимое множество химических реакций, в результате которых одни вещества превращаются в другие. Подавляющее большинство химических процессов остаются невидимыми, но именно они определяют свойства окружающего мира. Чтобы управлять превращениями веществ, необходимо как следует разобраться в природе подобных реакций. Для этого и нужна химия.
За то недолгое время, пока мы с вами изучаем химию, мы узнали о том, что существуют молекулы и атомы, химические реакции и физические явления, научились их различать.
Итак, тема сегодняшнего урока:
Типы химических реакций (слайд 1)
1.Сначала мы вспомним признаки химических реакций
Изменение окраски (слайд 3)
Иодид калия + нитрат свинца → нитрат калия + иодид свинца (цвет стал желтым)
Образование осадка
Сульфат меди + гидроксид натрия → сульфат натрия + гидроксид меди (осадок синего цвета) (слайд 4)
Выделение газа
Цинк + соляная кислота → хлорид цинка + водород↑ (выделяется газ водород) (слайд 5)
Выделение теплоты и света
Магний + кислород → оксид магния (выделяется лучистая энергия) (слайд 6)
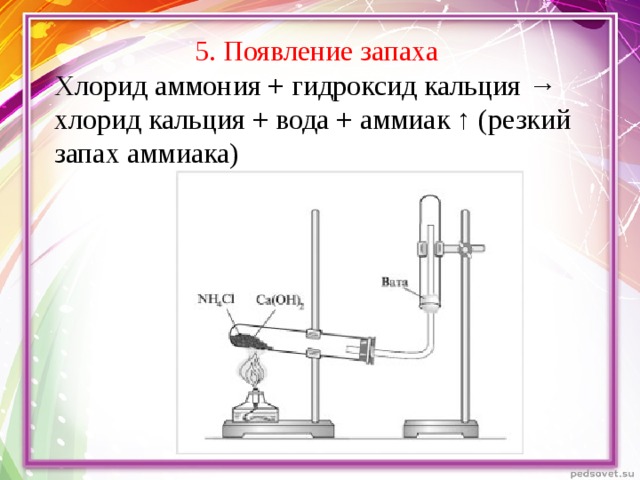
Появление запаха
Хлорид аммония + гидроксид кальция → хлорид кальция + вода + аммиак ↑ (резкий запах аммиака) (слайд 7)
2. Типы химических реакций.
Различают 4 типа химический реакций в зависимости от того как происходит перегруппировка атомов веществ они делятся на реакции соединения, разложения, замещения, обмена.
В процессе характеристики типов химических реакций – учащиеся выполняют лабораторные опыты или знакомятся с демонстрационным.
Инструктаж по технике безопасности (слайд 8)
При выполнении опытов следует соблюдать аккуратность.
Нельзя брать вещества руками. Для этого есть химическая ложка.
Реактивы в пробирку следует наливать не более 1-2 мл.
Пробирку с реагирующими веществами следует держать на уровне глаз, отвёрнутой от соседа.
1.Реакция соединения (демонстрация слайда с характеристикой реакций соединения) (слайд 9)
|
| Типы химических реакций |
| соединения |
| определение | В реакциях соединения из нескольких исходных веществ образуется одно сложное вещество |
| исходные вещества | Два или более простых или сложных вещества |
| продукты реакции | Одно сложное вещество |
| схема реакции | А + В = С |
Лабораторный опыт (учащиеся выполняют под руководством учителя) (слайд 10)
Оксид кальция + вода = гидроксид кальция
СаО + Н2О = Са(ОН)2
Закрепление (самостоятельная работа учащихся по заданию на слайде 11)
Закончить уравнения реакций соединения:
Магний + кислород → оксид магния
Mg + О2 →
Фосфор + кислород → оксид фосфора (V)
Р + О2 →
Оксид кальция + оксид углерода (IV) → карбонат кальция
СаО + СО2 →
Проверка правильности выполнения задания (слайд 12)
Магний + кислород → оксид магния
2Mg + О2 → 2MgО
Фосфор + кислород → оксид фосфора (V)
4Р + 5О2 → 2Р2О5
Оксид кальция + оксид углерода (IV) → карбонат кальция
СаО + СО2 → СаСО3
2. Реакция разложения (демонстрация слайда с характеристикой реакций разложения) (слайд 13)
|
| Типы химических реакций |
| разложения |
| определение | Реакции разложения приводят к распаду одного исходного сложного вещества на несколько продуктов. |
| исходные вещества | Одно сложное вещество |
| продукты реакции | Два или более простых или сложных вещества |
| схема реакции | С = А + В |
Демонстрационный опыт (слайд 14)
Малахит → оксид меди + вода + углекислый газ
(CuОН)2СО3 = 2CuO + H2O + CO2↑
Закрепление (самостоятельная работа учащихся по заданию на слайде 15)
Закончить уравнения реакций разложения:
Карбонат кальция → оксид кальция + углекислый газ
CaCO3 →
Гидроксид железа (III) → оксид железа (III) + вода
Fe(ОН)3 →
Вода → водород + кислород
H2O →
Проверка правильности выполнения задания (слайд 16):
Карбонат кальция → оксид кальция + углекислый газ
CaCO3 → CaO + CO2
Гидроксид железа (III) → оксид железа (III) + вода
2Fe(ОН)3 → Fe2О3 + 3H2O
Вода → водород + кислород
2H2O → 2Н2 + О2
3. Реакция замещения (демонстрация слайда с характеристикой реакций замещения) (слайд 17)
|
| Типы химических реакций |
|
| замещения |
| определение | Реакции замещения – это реакции между простым и сложным веществами, протекающие с образованием двух новых веществ – простого и сложного. |
| исходные вещества | Два вещества: простое и сложное |
| продукты реакции | Два новых вещества: простое и сложное |
| схема реакции | А + ВС = АС + В |
Лабораторный опыт (учащиеся выполняют под руководством учителя) (слайд 18)
Сульфат меди + железо → сульфат железа (II) + медь
CuSO4 + Fe → FeSO4 + Cu
Закрепление (самостоятельная работа учащихся по заданию на слайде 19)
Закончить уравнения реакций замещения:
Оксид железа (III) + алюминий → железо + оксид алюминия (III)
Fe2О3 + Аl →
Оксид железа (III) + водород → железо + вода
Fe2О3 + Н2 →
Цинк + соляная кислота → хлорид цинка + водород
Zn + HCl →
Проверка правильности выполнения заданий (слайд 20):
Оксид железа (III) + алюминий → железо + оксид алюминия (III)
Fe2О3 + 2Аl → Аl2О3 + 2Fe
Оксид железа (III) + водород → железо + вода
Fe2О3 + 3Н2 → 2Fe + 3Н2О
Цинк + соляная кислота → хлорид цинка + водород
Zn + 2HCl → ZnCl2 + Н2↑
4. Реакция обмена (демонстрация слайда с характеристикой реакций обмена) (слайд 21)
|
| Типы химических реакций |
| обмена |
| определение | Реакциями обмена называют взаимодействие между двумя сложными веществами, при котором они обмениваются атомами или группами атомов. |
| исходные вещества | Два сложных вещества |
| продукты реакции | Два новых сложных вещества |
| схема реакции | АВ + СД = АД + СВ |
Лабораторный опыт (учащиеся выполняют под руководством учителя) (слайд 22)
Сульфат меди + гидроксид натрия → сульфат натрия + гидроксид меди ↓
CuSO4 + 2NaОН → Na2 SO4 + Cu(ОН)2↓
Закрепление (самостоятельная работа учащихся по заданию на слайде 23)
Закончить уравнения реакций обмена:
Гидроксид натрия + соляная кислота → хлорид натрия + вода
NaОН + HCl →
Хлорид бария + нитрат серебра → нитрат бария + хлорид серебра↓
ВаCl2 + АgNО3 →
Нитрат бария + сульфат натрия → нитрат натрия + сульфат бария↓
Ва(NО3)2 + Na2 SO4 →
Проверка правильности выполнения заданий (слайд 24):
Гидроксид натрия + соляная кислота → хлорид натрия + вода
NaОН + HCl → NaCl + Н2О
Хлорид бария + нитрат серебра → нитрат бария + хлорид серебра↓
ВаCl2 + 2АgNО3 → Ва(NО3)2 + 2АgCl↓
Нитрат бария + сульфат натрия → нитрат натрия + сульфат бария↓
Ва(NО3)2 + Na2 SO4 → 2Na NО3 + ВаSO4↓
Задание на дом: повторить § 38, 39, 40, 41 (слайд 25)